
【题目】铬、钛及其化合物在工业上有重要用途,回答下列问题:
(1)Cr基态原子价层电子的轨道表达式(电子排布图)为_________________________。
(2)氮化铬(CrN)在超级电容器领域具有良好的应用前景,可由CrCl3·6H2O与尿素[(NH2)2CO]反应先得到配合物Cr[OC(NH2)2]6Cl3,然后在通有NH3和N2混合气体的反应炉内热分解制得。尿素构成元素中电负性由大到小的顺序为_________,中心碳原子的杂化类型为_________;Cr[OC(NH2)2]6Cl3含有的化学键类型有__________________。
(3)氮化铬的晶体结构类型与氯化钠的相同,氮化铬熔点(1282℃)比氯化钠的高,主要原因是_________________________________________。
(4)钙钛矿(CaTiO3)型的结构可看作氧化物超导相结构的基本单元。
①图A为立方钙钛矿(CaTiO3)结构的晶胞,晶胞边长为a nm。Ca处于晶胞的顶点,则Ti处于_________位置,O处于_________位置;与Ca紧邻的O个数为_________,Ti与O间的最短距离为____________________nm 。
②在图B中画出立方钙钛矿晶胞结构的另一种表示(要求:Ti处于晶胞的顶点;![]() ,
,![]() ,
,![]() 所代表的原子种类与图A相同)____________________。
所代表的原子种类与图A相同)____________________。

【答案】 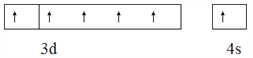 O>N>C>H sp2 配位键、共价键、离子键 氮化铬的离子电荷数较多,晶格能较大 体心 棱心 6
O>N>C>H sp2 配位键、共价键、离子键 氮化铬的离子电荷数较多,晶格能较大 体心 棱心 6 ![]()
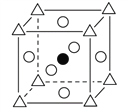
【解析】(1)24号元素是铬,其价层电子排布式为3d54s1,则轨道表达式为:![]() ;(2)(NH2)2CO中含有N、H、O、C,电负性由大到小的顺序为O>N>C>H,(NH2)2CO结构中碳原子上有二根单键、一个双键,则参加杂化轨道数为:(2+1)(1是双键中一个单键),杂化类型为sp2。(3)氮化铬的晶体与氯化钠晶体都是离子晶体,因为氮化铬的离子电荷数较多,晶格能较大,所以,氮化铬熔点比氯化钠的高。(4)①由晶胞图分析,黑球为1个,白球为12/4=3个,三角为1个,因TiO32—中钛与氧结合形成酸根离子,则三角所处位置为钛,即体心位置,氧位于立方体棱上;由三维立体对称分析,与Ca紧邻的O个数为6,Ti与O间的最短距离是面对角线的一半,即
;(2)(NH2)2CO中含有N、H、O、C,电负性由大到小的顺序为O>N>C>H,(NH2)2CO结构中碳原子上有二根单键、一个双键,则参加杂化轨道数为:(2+1)(1是双键中一个单键),杂化类型为sp2。(3)氮化铬的晶体与氯化钠晶体都是离子晶体,因为氮化铬的离子电荷数较多,晶格能较大,所以,氮化铬熔点比氯化钠的高。(4)①由晶胞图分析,黑球为1个,白球为12/4=3个,三角为1个,因TiO32—中钛与氧结合形成酸根离子,则三角所处位置为钛,即体心位置,氧位于立方体棱上;由三维立体对称分析,与Ca紧邻的O个数为6,Ti与O间的最短距离是面对角线的一半,即![]() nm。②不论如何画图,原子个数比不变,原子配位数不变,故新的结构图:
nm。②不论如何画图,原子个数比不变,原子配位数不变,故新的结构图: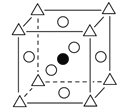 。
。


科目:高中化学 来源: 题型:
【题目】把7.4 g Na2CO3·10H2O 和 NaHCO3组成的混合物溶于水配成100mL溶液,其中c(Na+)=0.6mol/L。若把等质量的混合物加热至恒重,残留物的质量是
A. 5.28g B. 2.12g C. 4.22g D. 3.18g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或事故处理正确的是( )
A. 金属钠着火,立即用水扑灭
B. 实验结束后,用嘴吹灭酒精灯
C. 皮肤不慎沾上NaOH溶液,立即用盐酸冲洗
D. 稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断搅拌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国幅员辽阔,资源丰富,可为硫酸、玻璃、铁和铝等化工产品的生产提供原料。下列原料选择不正确的是
A. 以赤铁矿为原料冶炼铁 B. 以硫铁矿为原料生产硫酸
C. 以铝土矿为原料生产金属铝 D. 以冰晶石为原料生产普通玻璃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关乙烯、苯分子的的描述不正确的是 ( )
A. 碳原子都采用sp2杂化 B. 分子中都含有σ键和π键
C. 分子都是平面结构 D. 都能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)含碳物质不完全燃烧会产生CO。血红蛋白中含有Fe2+,CO易与血红蛋白结合成稳定的配合物而使人中毒,写出铁离子(Fe3+)的核外电子排布式为_____________,CO有多种等电子体,其中常见的一种分子是__________。利用CO可以合成化工原料COCl2、配合物Fe(CO)5等,已知一个COCl2分子中每个原子最外层都形成8电子的稳定结构,则一个COCl2分子内含有_____个δ键,C原子的杂化方式为__________。Fe(CO)5等在一定条件下分解生成CO和铁,反应过程中断裂的化学键是__________,形成的化学键是___________。
(2)A、B均为短周期金属元素。依据下表数据,回答问题:
电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15390 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
写出A原子的电子排布图_______________,Al原子的第一电离能_____(填:“大于”、“小于”或“等于”)738 kJ·mol-1,原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据已学知识,请你回答下列问题:
(1)写出原子序数最小的第Ⅷ族元素原子的原子结构示意图__________。
(2)写出3p轨道上有2个未成对电子的元素的符号:______________。
(3)该元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布式为4s24p4,该元素的名称是____________。
(4)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1 mol NH4BF4含有____ mol配位键。
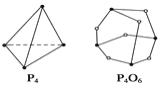
(5)化学反应可视为旧键的断裂和新键的形成过程。化学键的键能是形成化学键时释放的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P—P:198 P—O:360 O===O:498,则反应P4(白磷)+3O2===P4O6的反应热ΔH为______。
(6)写出二氧化硫中的S原子和水合氢离子中O原子分别采用______和______杂化形式,二氧化硫分子和水合氢离子其空间构型分别为________和__________。
(7)HF水溶液中含有的氢键共_______________种。
(8)无水CoCl2为深蓝色,吸水后变为粉红色的水合物,水合物受热后又变成无水CoCl2,故常在实验室中用作吸湿剂和空气湿度指示剂。
CoCl2+xH2O = CoCl2·xH2O
深蓝色 粉红色
现有65g无水CoCl2,吸水后变成CoCl2·xH2O 119g。(CoCl2的相对分子质量:131)
①水合物中x=________。
②若该化合物中Co2+配位数为6,而且经定量测定得知内界和外界占有Cl-的个数比为1∶1,则其化学式可表示为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com