
【题目】(1)含碳物质不完全燃烧会产生CO。血红蛋白中含有Fe2+,CO易与血红蛋白结合成稳定的配合物而使人中毒,写出铁离子(Fe3+)的核外电子排布式为_____________,CO有多种等电子体,其中常见的一种分子是__________。利用CO可以合成化工原料COCl2、配合物Fe(CO)5等,已知一个COCl2分子中每个原子最外层都形成8电子的稳定结构,则一个COCl2分子内含有_____个δ键,C原子的杂化方式为__________。Fe(CO)5等在一定条件下分解生成CO和铁,反应过程中断裂的化学键是__________,形成的化学键是___________。
(2)A、B均为短周期金属元素。依据下表数据,回答问题:
电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15390 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
写出A原子的电子排布图_______________,Al原子的第一电离能_____(填:“大于”、“小于”或“等于”)738 kJ·mol-1,原因是_________________。
【答案】 1s22s22p63s23p63d5 N2 3个 sp2 配位键 金属键 ![]() 小于 由表中数据判断B为Mg元素,其最外层电子排布式为3s2,而Al最外层电子排布式为3s23p1,当3p处于全充满、半充满或全空时较稳定,因此,失去p亚层的1个电子相对比较容易。
小于 由表中数据判断B为Mg元素,其最外层电子排布式为3s2,而Al最外层电子排布式为3s23p1,当3p处于全充满、半充满或全空时较稳定,因此,失去p亚层的1个电子相对比较容易。
【解析】(1)![]() 的核外电子排布为
的核外电子排布为![]() ,因此
,因此![]() 的核外电子排布式为
的核外电子排布式为![]() ;
;![]() 的电子数为14,
的电子数为14,![]() 的电子数也为14;
的电子数也为14;![]() 分子的结构简式为
分子的结构简式为 ,共价单键为σ键,共价双键含有一个π键,一个σ键,因此一个
,共价单键为σ键,共价双键含有一个π键,一个σ键,因此一个![]() 分子内含有3个σ键;该分子中有一个
分子内含有3个σ键;该分子中有一个![]() 双键和两个
双键和两个![]() 单键,因此
单键,因此![]() 原子杂化方式为
原子杂化方式为![]() ;
;![]() 的配体的中心原子为金属原子,由于断裂的是中心原子和配体之间的配位键,所以断裂后配体形成CO,中心原子间形成金属键成为金属晶体;正确答案: 1s22s22p63s23p63d5 ;N2 ;3个; sp2 ; 配位键 ;金属键 。
的配体的中心原子为金属原子,由于断裂的是中心原子和配体之间的配位键,所以断裂后配体形成CO,中心原子间形成金属键成为金属晶体;正确答案: 1s22s22p63s23p63d5 ;N2 ;3个; sp2 ; 配位键 ;金属键 。
(2)由表中数据可知,A、B元素的第三电离能都剧增,故表现+2价,为第ⅡA族元素,B的第一电离能比A的小,故A为![]() 元素,B为
元素,B为![]() 元素,则
元素,则![]() 的电子排布图为
的电子排布图为![]() ,因B为
,因B为![]() 元素,其最外层电子排布式为
元素,其最外层电子排布式为![]() ,而
,而![]() 最外层电子排布式为
最外层电子排布式为![]() ,当
,当![]() 处于全充满、半充满或全空时较稳定,因此,失去
处于全充满、半充满或全空时较稳定,因此,失去![]() 亚层的1个电子相对比较容易,因此
亚层的1个电子相对比较容易,因此![]() 原子第一电离能小于
原子第一电离能小于![]() 原子第一电离能;正确答案:
原子第一电离能;正确答案: ![]() ;小于; 由表中数据判断B为Mg元素,其最外层电子排布式为3s2,而Al最外层电子排布式为3s23p1,当3p处于全充满、半充满或全空时较稳定,因此,失去p亚层的1个电子相对比较容易。
;小于; 由表中数据判断B为Mg元素,其最外层电子排布式为3s2,而Al最外层电子排布式为3s23p1,当3p处于全充满、半充满或全空时较稳定,因此,失去p亚层的1个电子相对比较容易。


 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
【题目】某研究小组欲探究Na2O2与水的反应,可供使用的试剂有:Na2O2、蒸馏水、KMnO4酸性溶液、MnO2。Na2O2样品与过量水反应,待完全反应不再产生氧气后,得溶液X。查阅资料表明,Na2O2与水反应还可生成H2O2。
(1)写出Na2O2与水生成O2的化学反应方程式______________,每生成1mol O2,转移电子的物质的量为______________。
(2)Na2O2与水反应生成H2O2的反应是否属于氧化还原反应_______(填是、否)。
(3)若已知溶液X可使酸性KMnO4溶液褪色,同时放出氧气,完成并配平该反应的离子方程式:____MnO4-+____H2O2+____H+—____Mn2++____O2↑+____ 。____________
(4)取40 gNa2O2固体粉末与一定量二氧化碳反应后,固体质量变为47g,则该反应中消耗Na2O2的质量是________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬、钛及其化合物在工业上有重要用途,回答下列问题:
(1)Cr基态原子价层电子的轨道表达式(电子排布图)为_________________________。
(2)氮化铬(CrN)在超级电容器领域具有良好的应用前景,可由CrCl3·6H2O与尿素[(NH2)2CO]反应先得到配合物Cr[OC(NH2)2]6Cl3,然后在通有NH3和N2混合气体的反应炉内热分解制得。尿素构成元素中电负性由大到小的顺序为_________,中心碳原子的杂化类型为_________;Cr[OC(NH2)2]6Cl3含有的化学键类型有__________________。
(3)氮化铬的晶体结构类型与氯化钠的相同,氮化铬熔点(1282℃)比氯化钠的高,主要原因是_________________________________________。
(4)钙钛矿(CaTiO3)型的结构可看作氧化物超导相结构的基本单元。
①图A为立方钙钛矿(CaTiO3)结构的晶胞,晶胞边长为a nm。Ca处于晶胞的顶点,则Ti处于_________位置,O处于_________位置;与Ca紧邻的O个数为_________,Ti与O间的最短距离为____________________nm 。
②在图B中画出立方钙钛矿晶胞结构的另一种表示(要求:Ti处于晶胞的顶点;![]() ,
,![]() ,
,![]() 所代表的原子种类与图A相同)____________________。
所代表的原子种类与图A相同)____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是
A. 从1L1mol·L-1的NaCl溶液中取出10mL,其浓度仍是1mol·L-1
B. 制备0.5L 10mol·L-1的盐酸,需要氯化氢气体112L(标准状况)
C. 0.5L 2mol·L-1BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023
D. 10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种重要的化工原料,某学习小组通过下述实验制备亚硝酸钠,并测定所制备亚硝酸钠的纯度。
(一)利用下列装置制备NaNO2。
已知:①2NO+Na2O2=2NaNO2;② NO和NO2-均能被酸性高锰酸钾氧化为NO3-。
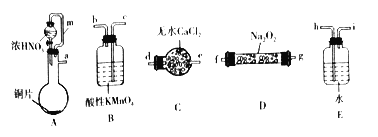
(1)选择上述仪器完成实验,其连按顺序为_______________(按气流方向,用小写字母表示)。
(2)装置A中m管的作用为_________________。
(3)装置B中发生反应的离子方程式为____________________________________________________。
(二)测定上述实验所制备的NaNO2样品(含NaNO3和Na2CO3 杂质)的纯度。
称量D中所得样品ag溶解后配制成250 mL 溶液,取25.00mL于锥形瓶用6mol·L-1 的酸性高锰酸钾溶液滴定到终点;重复上述滴定操作两次,测得数据如下表:
第一次 | 第二次 | 第三次 | |
酸性高锰酸钾溶液休积/mL | 19.98 | 19.75 | 20.02 |
(4)盛装酸性高锰酸钾溶液前需对酸式滴定管进行的操作为__________________________。
(5)滴定到终点的实验现象为_________________________________________________。
(6)下列实验操作可能导致出现上表中第二次实验数据的是________(填字母编号)。
a.滴定时有部分酸性高锰酸钾溶液滴在锥形瓶外
b.加入样品溶液前的锥形瓶未经干燥
c.滴定前仰视读数,滴定后俯视读数
(7)最终所得样品中NaNO2 的质量分数为_____________(用含a、b的关系式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图海水综合利用的工艺流程图,判断下列说法正确的是 ( )

已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
A. 过程①的提纯是物理过程
B. 在过程③中将MgCl2·6H2O灼烧即可制得无水MgCl2
C. 过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题
D. 工业上采用向母液中加入烧碱的方法获得氢氧化镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.P4和CH4的空间构型和键角都相同
B.O3与OF2都是V形分子
C.SO3和SeO32-的立体构型都是三角锥形
D.HOCH2CH(OH)CH2OH与CH3CHClCH2CH3都是手性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是
A. CaCO3+2HCl=CaCl2+CO2↑+ H2O
B. CaO+H2O=Ca(OH)2
C. 2H2O2![]() 2H2O+O2↑
2H2O+O2↑
D. CaCO3![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com