
【题目】亚硝酸钠(NaNO2)是一种重要的化工原料,某学习小组通过下述实验制备亚硝酸钠,并测定所制备亚硝酸钠的纯度。
(一)利用下列装置制备NaNO2。
已知:①2NO+Na2O2=2NaNO2;② NO和NO2-均能被酸性高锰酸钾氧化为NO3-。
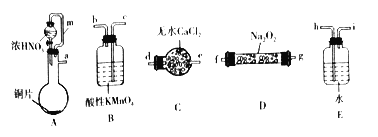
(1)选择上述仪器完成实验,其连按顺序为_______________(按气流方向,用小写字母表示)。
(2)装置A中m管的作用为_________________。
(3)装置B中发生反应的离子方程式为____________________________________________________。
(二)测定上述实验所制备的NaNO2样品(含NaNO3和Na2CO3 杂质)的纯度。
称量D中所得样品ag溶解后配制成250 mL 溶液,取25.00mL于锥形瓶用6mol·L-1 的酸性高锰酸钾溶液滴定到终点;重复上述滴定操作两次,测得数据如下表:
第一次 | 第二次 | 第三次 | |
酸性高锰酸钾溶液休积/mL | 19.98 | 19.75 | 20.02 |
(4)盛装酸性高锰酸钾溶液前需对酸式滴定管进行的操作为__________________________。
(5)滴定到终点的实验现象为_________________________________________________。
(6)下列实验操作可能导致出现上表中第二次实验数据的是________(填字母编号)。
a.滴定时有部分酸性高锰酸钾溶液滴在锥形瓶外
b.加入样品溶液前的锥形瓶未经干燥
c.滴定前仰视读数,滴定后俯视读数
(7)最终所得样品中NaNO2 的质量分数为_____________(用含a、b的关系式表示)。
【答案】 a→hi→de→fg(gf)→c 平衡压强,使浓硝酸顺利滴下 5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O 检查是否漏液,清洗、润洗酸式滴定管 溶液由无色变为紫色(或红色),且半分钟不褪色 c ![]() ×100%
×100%
【解析】(一). (1). 利用A装置制备的是NO2,所以制备完毕后需通过水将其转化为NO,经过干燥后进行实验,最后进行尾气处理,因此连接顺序为:a→hi→de →fg(gf)→c,故答案为:a→hi→de→fg(gf)→c;
(2). 装置A中连接m管,可以起到平衡压强,使上下压强一致,让浓硝酸顺利滴下,故答案为:平衡压强,使浓硝酸顺利滴下;
(3). 进入装置B中的气体是NO,根据题意可知,NO被高锰酸钾氧化为NO3-,MnO4-变成Mn2+,根据得失电子守恒和原子守恒,该反应的离子方程式为:5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O,故答案为:5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O;
(二). (4). 酸式滴定管在使用前需要检查是否漏液,用水洗涤后再用酸性高锰酸钾溶液润洗,故答案为:检查是否漏液,清洗、润洗酸式滴定管;
(5). 滴定到终点时,溶液由无色变为紫色(或红色),且半分钟内不褪色,故答案为:溶液由无色变为紫色(或红色),且半分钟不褪色;
(6). 表中第二次实验数据表明消耗的酸性高锰酸钾溶液体积偏小,a. 滴定时有部分酸性高锰酸钾溶液滴在锥形瓶外,会导致消耗标准液的体积偏大,故a不选;b. 加入样品溶液前的锥形瓶未干燥,对实验结果无影响,故b不选;c. 滴定前仰视读数,滴定后俯视读数,会导致读取标准液的体积偏小,故c选;答案选:c;
(7). 滴定过程中发生的反应为:5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O,由方程式可知,2MnO4-~5NO2-,设样品中NaNO2的物质的量为xmol,则有:
2MnO4- ~ 5NO2-
2 5
bmol/L×0.02L xmol
样品中NaNO2的质量分数为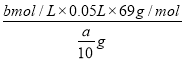 ×100%=
×100%= ![]() ×100%,故答案为:
×100%,故答案为: ![]() ×100%。
×100%。


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子,下列说法正确的是 ( )
A. X元素原子基态时的电子排布式为[Ar]4s24p3 B. X元素是第四周期第ⅤA族元素
C. Y元素原子的电子排布式为1s22s22p2 D. Z元素具有两性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用pH计测量VmL0.1mol·L-1NaOH溶液中逐滴滴加等浓度的一元酸HA后pH的变化情况,绘制pH变化曲线如图所示,下列说法不正确的是( )

A. A点溶液的pH=13
B. B和C两点所示溶液中水的电离程度:B>C
C. pH=7时,溶液中存在:c(Na+)=c(H+)+(HA)
D. C点所示溶液中离子浓度大小顺序:c(A-)>c(Na+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)含碳物质不完全燃烧会产生CO。血红蛋白中含有Fe2+,CO易与血红蛋白结合成稳定的配合物而使人中毒,写出铁离子(Fe3+)的核外电子排布式为_____________,CO有多种等电子体,其中常见的一种分子是__________。利用CO可以合成化工原料COCl2、配合物Fe(CO)5等,已知一个COCl2分子中每个原子最外层都形成8电子的稳定结构,则一个COCl2分子内含有_____个δ键,C原子的杂化方式为__________。Fe(CO)5等在一定条件下分解生成CO和铁,反应过程中断裂的化学键是__________,形成的化学键是___________。
(2)A、B均为短周期金属元素。依据下表数据,回答问题:
电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15390 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
写出A原子的电子排布图_______________,Al原子的第一电离能_____(填:“大于”、“小于”或“等于”)738 kJ·mol-1,原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,能证明SiO2是酸性氧化物的是( )
A.SiO2+2C═Si+2CO↑
B.SiO2+2NaOH═Na2SiO3+H2O
C.SiO2+4HF═SiF4↑+2H2O
D.SiO2+CaCO3═CaSiO3+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求填写下列空白。
(1)实验室制取CO2的离子反应方程式:________________________________________;
(2)氢氧化钡和硫酸镁溶液混合反应的离子方程式:_______________________________;
(3)氢氧化铁胶体制备的离子反应:_____________________________________________;
(4)同温同压条件下,等质量的CO和CO2的密度比为:__________。
(5)在NaH+H2O=NaOH+H2↑中,还原剂为________,生成1molH2时转移电子为___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代科学的发展使游离态的氮家庭又添新丁,据报道:意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构与P4相似,已知断裂1molN-N吸收167kJ热量,生成1molN≡N放出942kJ热量。根据以上信息和数据,下列说法正确的是
A. N4属于一种新型的化合物 B. N4和N2互为同位素
C. N4与N2互为同素异形体 D. 1molN4气体转变为N2将吸收882kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置探究碳酸和苯酚的酸性强弱,下列叙述不正确的是(部分夹持仪器省略)

A. ②中试剂为饱和NaHCO3溶液
B. 打开分液漏斗旋塞,①中产生无色气泡,③中出现白色浑浊
C. 苯酚有弱酸性,是由于苯基影响了与其相连的羟基的活性
D. ③中发生反应的化学方程式是2![]() +CO2 +H2O
+CO2 +H2O![]() +Na2CO3
+Na2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com