
下列各溶液中,pH最大的是( )
A.pH=9的氨水稀释1 000倍
B.pH=9的烧碱溶液稀释1 000倍
C.pH=5的盐酸稀释1 000倍
D.pH=5的氯化铵溶液稀释1 000倍
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源:2014年化学高考总复习课时演练9-2电解池金属电化学腐蚀与防护练习卷(解析版) 题型:选择题
图中X为电源,Y为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向d端扩散。下列判断正确的是( )
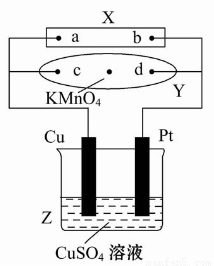
A.滤纸上c点附近会变红色
B.Cu电极质量减小,Pt电极质量增大
C.Z中溶液的pH先减小,后增大
D.溶液中的SO42-向Cu电极定向移动
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 8-4难溶电解质的溶解平衡练习卷(解析版) 题型:选择题
下表列出了几种常见物质的电离常数或溶度积:
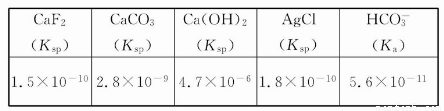
在一定量的0.2 mol/L CaCl2溶液中加入等体积的下列溶液,可以产生沉淀的是( )
A.由水电离出的c(H+)=10-9 mol/L的HF溶液
B.pH=10的氨水
C.1 mol/L的NaHCO3溶液
D.10-9 mol/L的AgNO3溶液
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 8-3盐类的水解练习卷(解析版) 题型:选择题
在0.1 mol/L的醋酸钠溶液中加入等体积的下列物质,溶液中离子浓度大小关系正确的是( )
A.水;c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
B.0.1 mol/L盐酸;c(Na+)=c(Cl-)>c(H+)>c(CH3COO-)>c(OH-)
C.0.1 mol/L醋酸;c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.0.1 mol/L氢氧化钠;c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 8-2水的电离和溶液的酸碱性练习卷(解析版) 题型:选择题
25 ℃时,在等体积的①pH=0的硫酸溶液、②0.05 mol/L的Ba(OH)2溶液、③pH=10的Na2S溶液、④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是( )
A.1∶10∶1010∶109 B.1∶5∶5×109∶5×108
C.1∶20∶1010∶109 D.1∶10∶104∶109
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 8-1弱电解质的电离练习卷(解析版) 题型:实验题
甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动。实验方案如下:
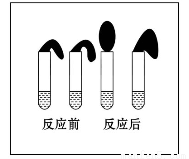
甲:取纯度相同,质量、大小相等的锌粒于两支试管中,同时加入 0.1 mol·L-1的HA溶液、稀盐酸各10 mL,按图装好,观察现象。
乙:① 用pH计测定浓度均为0.1 mol·L-1 的HA溶液和稀盐酸的pH;
② 再取0.1 mol·L-1的HA溶液和稀盐酸各2滴(1滴约为1/20 mL)分别稀释至100 mL,再用pH计测其pH变化。
(1)乙的方案中说明HA是弱电解质的理由是:测得0.1 mol·L-1的HA溶液的
pH 1(填“>”、“<”或“=”);甲方案中,说明HA是弱电解质的实验现象是:
(填序号)
A.加入两种稀酸后,两个试管上方的气球同时鼓起,且一样大
B.加入HA溶液后,试管上方的气球鼓起慢
C.加入稀盐酸后,试管上方的气球鼓起慢
(2) 乙同学设计的实验第 步,能证明改变条件弱电解质平衡发生移动。甲同学为了进一步证明弱电解质电离平衡移动的情况,设计如下实验:
①使HA的电离程度和c(H+)都减小,c(A-)增大,可在0.1 mol·L-1的HA溶液中,选择加入 试剂(选填“A”、“B”、“C”或“D”,下同);
②使HA的电离程度减小,c(H+)和c(A-)都增大,可在0.1 mol·L-1的HA溶液中,选择加入 试剂。
A.NaA固体(可完全溶于水)
B.1 mol·L-1 NaOH溶液
C.1 mol·L-1 H2SO4
D.2 mol·L-1 HA
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 8-1弱电解质的电离练习卷(解析版) 题型:选择题
0.1 mol·L-1氨水10 mL,加蒸馏水稀释到1 L后,下列变化中正确的是( )
①电离程度增大;②c(NH3·H2O)增大;③NH4+数目增多;④c(OH-)增大;⑤导电性增强;⑥ 增大
增大
A.①②③ B.①③⑤ C.①③⑥ D.②④⑥
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 7-2化学平衡状态化学平衡移动练习卷(解析版) 题型:填空题
某恒容容器内发生的可逆反应的化学平衡常数表达式为: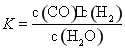 。能判断该反应一定达到化学平衡状态的依据是( )
。能判断该反应一定达到化学平衡状态的依据是( )
①容器中气体的平均相对分子质量不随时间而变化
②v正(H2O)=v逆(H2)
③容器中气体的密度不随时间而变化
④容器中气体总质量不随时间而变化
⑤消耗n mol H2的同时消耗n mol CO
A.①②③ B.①②③④ C.② D.①④⑤
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 5-2元素周期表 元素周期律练习卷(解析版) 题型:填空题
下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题:

(1)④、⑤、⑦的原子半径由大到小的顺序为 (用元素符号表示,下同)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为 > 。
(3)①、②两种元素按原子个数之比为1∶1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式 。
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。

①写出D溶液与G反应的化学方程式 。
②写出检验A溶液中溶质的阴离子的方法: 。
③常温下,若电解1 L 0.1 mol/L的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为 mol。
④若上图中各步反应均为恰好完全转化,则混合物X中含有的物质有 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com