
下表列出了几种常见物质的电离常数或溶度积:
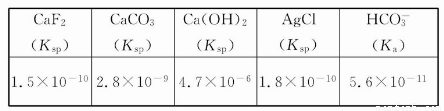
在一定量的0.2 mol/L CaCl2溶液中加入等体积的下列溶液,可以产生沉淀的是( )
A.由水电离出的c(H+)=10-9 mol/L的HF溶液
B.pH=10的氨水
C.1 mol/L的NaHCO3溶液
D.10-9 mol/L的AgNO3溶液
C
【解析】加入等体积的溶液后,CaCl2溶液被稀释。现分别计算如下:A溶液中c(OH-)=10-9 mol/L,则c(H+)=10-5 mol/L,而c(F-)≈c(H+)=10-5 mol/L,混合后,c(F-)<10-5 mol/L,即便是按10-5 mol/L计算,(10-5)2×0.1也小于1.5×10-10,因而无沉淀生成。B中也无沉淀生成,计算方法同上。C中c(HCO3-)≈0.5 mol/L,由于溶液呈碱性,则c(H+)<10-7 mol/L,再根据Ka ,估算c(CO32-)>2.8×10-4 mol/L。而c(Ca2+)·c(CO32-)>0.1×2.8×10-4>2.8×10-9,因而有沉淀生成。同样可分析知D中无沉淀生成。


科目:高中化学 来源:2014年化学高考课时演练10甲烷乙烯苯煤石油天然气的综合利用练习卷(解析版) 题型:填空题
下表是A、B、C、D、E五种有机物的有关信息:
A①能使溴的四氯化碳溶液褪色;
②比例模型为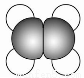
③能与水在一定条件下反应生成C
B①由C、H两种元素组成。
②球棍模型为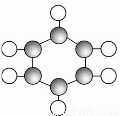
C①由C、H、O三种元素组成;
②能与Na反应;
③与E反应生成相对分子质量为88的酯
D①相对分子质量比C少2;
②能由C催化氧化得到
E①由C、H、O三种元素组成;
②其水溶液能使紫色石蕊试液变红
回答下列问题:
(1)A~E中,属于烃的是___________(填字母)。
(2)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为_______________。
(3)C催化氧化生成D的化学方程式为_________________________________。
(4)有机物B具有的性质是__________ (填序号)。
①无色无味的液体;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色
(5)E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来比较E与碳酸酸性的强弱,则该实验的原理是________________________(用化学方程式说明)。
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练3-4金属材料用途 金属矿物利用练习卷(解析版) 题型:填空题
以黄铜矿(主要成分为CuFeS2,含少量杂质SiO2等)为原料进行炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要流程如下:

已知:① 4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O
②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如表
沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 4.7 | 2.7 | 7.6 |
完全沉淀pH | 6.7 | 3.7 | 9.6 |
(1)试剂a是__________,试剂b是__________。
(2)操作X应为蒸发浓缩、__________、__________。
(3)反应Ⅱ中加CuO调pH为__________,目的是使Fe3+形成Fe(OH)3沉淀,防止生成Cu(OH)2沉淀。
(4)反应Ⅴ的离子方程式为:__________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 9-1原电池 化学电源练习卷(解析版) 题型:选择题
下列防腐措施中,利用原电池反应使主要金属得到保护的是( )
A.用氧化剂使金属表面生成致密稳定的氧化物保护膜
B.在金属中加入一些铬或镍制成合金
C.在轮船的壳体水线以下部分装上锌锭
D.金属表面喷漆
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 8-4难溶电解质的溶解平衡练习卷(解析版) 题型:填空题
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意图如下:

(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
Fe+2Fe3+=3Fe2+
2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
加入铁屑的作用是 。
(2)在②→ ③工艺过程中需要控制条件以形成TiO2·nH2O溶胶,该溶胶的分散质颗粒直径大小在 范围。
(3)若把③中制得的固体TiO2·nH2O用酸清洗除去其中的杂质,还可制得钛白粉。已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+  Fe3++3H2O的平衡常数K= 。
Fe3++3H2O的平衡常数K= 。
(4)已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g)
ΔH=+140 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式: 。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是 (只要求写出一项 )。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4,可采用_______方法。

查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 8-4难溶电解质的溶解平衡练习卷(解析版) 题型:选择题
已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3
主要:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑
次要:Cu2++CO32-=CuCO3↓(几乎不发生反应。下同)
(2)CuSO4+Na2S
主要:Cu2++S2-=CuS↓
次要:Cu2++S2-+2H2O=Cu(OH)2↓+H2S↑
则下列几种物质的溶解度大小的比较中,正确的是( )
A.CuS<Cu(OH)2<CuCO3
B.CuS>Cu(OH)2>CuCO3
C.Cu(OH)2>CuCO3>CuS
D.Cu(OH)2<CuCO3<CuS
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 8-3盐类的水解练习卷(解析版) 题型:选择题
25 ℃时,在1.0 L浓度均为0.01 mol·L-1的某一元酸HA与其钠盐组成的混合溶液中,测得c(Na+)>c(A-),则下列描述中不正确的是( )
A.该溶液的pH<7
B.HA的酸性很弱,A-水解程度较大
C.c(A-)+c(HA)=0.02 mol·L-1
D.n(A-)+n(OH-)=0.01 mol+n(H+)
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 8-2水的电离和溶液的酸碱性练习卷(解析版) 题型:选择题
下列各溶液中,pH最大的是( )
A.pH=9的氨水稀释1 000倍
B.pH=9的烧碱溶液稀释1 000倍
C.pH=5的盐酸稀释1 000倍
D.pH=5的氯化铵溶液稀释1 000倍
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 7-1化学反应速率及影响因素练习卷(解析版) 题型:选择题
对于反应2SO2(g)+O2(g) 2SO3(g)能增大正反应速率的措施是( )
2SO3(g)能增大正反应速率的措施是( )
A.通入大量O2 B.增大容器容积
C.移去部分SO2 D.降低体系温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com