
以黄铜矿(主要成分为CuFeS2,含少量杂质SiO2等)为原料进行炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要流程如下:

已知:① 4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O
②部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如表
沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 4.7 | 2.7 | 7.6 |
完全沉淀pH | 6.7 | 3.7 | 9.6 |
(1)试剂a是__________,试剂b是__________。
(2)操作X应为蒸发浓缩、__________、__________。
(3)反应Ⅱ中加CuO调pH为__________,目的是使Fe3+形成Fe(OH)3沉淀,防止生成Cu(OH)2沉淀。
(4)反应Ⅴ的离子方程式为:__________________________________________。
(1)Fe(或铁) 稀硫酸
(2)冷却结晶 过滤(洗涤干燥)
(3)3.7~4.7
(4)Fe+2Fe3+=3Fe2+
【解析】以黄铜矿为原料进行炼铜,同时得到副产品绿矾的主要流程如下:反应Ⅰ是将CuFeS2转化为CuSO4和Fe2(SO4)3,并过滤除去SiO2。反应Ⅱ是通过水解反应分离CuSO4和Fe2(SO4)3,根据表中给出的数据可知,Fe3+的氢氧化物从开始沉淀到沉淀完全的pH范围是2.7~3.7,Cu2+的氢氧化物从开始沉淀到沉淀完全的pH范围是4.7~6.7,要想将溶液中的Fe3+完全沉淀且Cu2+不能沉淀,需要调节溶液的pH为3.7~4.7;为了不引入新杂质,可以向溶液中加入CuO调节溶液的pH至3.7~4.7,此时Fe3+完全沉淀;最后过滤,即可得到纯净的CuSO4溶液和Fe(OH)3沉淀。由实验目的知,反应Ⅲ是将CuSO4转化为Cu,所以加入的试剂a是过量的Fe,反应后过滤得到FeSO4溶液和Fe、Cu混合物。反应Ⅳ是从Fe、Cu混合物中得到Cu,所以加入的试剂b是稀硫酸。反应Ⅴ是将Fe2(SO4)3转化为FeSO4溶液,发生反应的离子方程式为:Fe+2Fe3+=3Fe2+。操作X是从FeSO4溶液中得到绿矾,操作方法为:蒸发浓缩、冷却结晶、过滤。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014年化学高考题型专练二 化学常用计量的理解和综合应用练习卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列叙述正确的是 ( )。
A.98 g的H2SO4和H3PO4中含有的氧原子数均为4NA
B.相同物质的量浓度和相同体积的硫酸与高氯酸(HClO4)溶液中含有的氧原子数均为4NA
C.33.6 L NO2溶于足量的水得到的溶液中含有的NO3—数为NA
D.32 g铜发生氧化还原反应,一定失去NA个电子
查看答案和解析>>
科目:高中化学 来源:2014年化学高考课时演练10甲烷乙烯苯煤石油天然气的综合利用练习卷(解析版) 题型:选择题
对下列化学用语的理解正确的是( )
A.离子结构示意图 既可以表示35Cl-,也可以表示37Cl-
既可以表示35Cl-,也可以表示37Cl-
B.电子式 既可以表示羟基,也可以表示氢氧根离子
既可以表示羟基,也可以表示氢氧根离子
C.比例模型 既可以表示甲烷分子,也可以表示四氯化碳分子
既可以表示甲烷分子,也可以表示四氯化碳分子
D.结构简式(CH3)2CHCH3既可以表示正丁烷,也可以表示异丁烷
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练9-2电解池金属电化学腐蚀与防护练习卷(解析版) 题型:选择题
图中X为电源,Y为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向d端扩散。下列判断正确的是( )
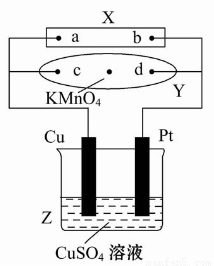
A.滤纸上c点附近会变红色
B.Cu电极质量减小,Pt电极质量增大
C.Z中溶液的pH先减小,后增大
D.溶液中的SO42-向Cu电极定向移动
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练9-2电解池金属电化学腐蚀与防护练习卷(解析版) 题型:选择题
如图所示是探究铁发生腐蚀的装置图。发现开始时U形管左端红墨水水柱下降,一段时间后U形管左端红墨水水柱又上升。下列说法中不正确的是( )

A.开始时发生的是析氢腐蚀
B.一段时间后发生的是吸氧腐蚀
C.两种腐蚀负极的电极反应式均为Fe-2e-=Fe2+
D.析氢腐蚀的总反应式为2Fe+O2+2H2O=2Fe(OH)2
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练3-4金属材料用途 金属矿物利用练习卷(解析版) 题型:选择题
下列有关纯铁的叙述正确的是( )
A.熔点比生铁的低
B.与相同浓度的盐酸反应生成氢气的速率比生铁的快
C.在冷的浓硫酸中可以钝化
D.在潮湿空气中比生铁容易被腐蚀
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 9-1原电池 化学电源练习卷(解析版) 题型:填空题
科研、生产中常涉及钠、硫及其化合物。
(1)实验室可用无水乙醇处理少量残留的金属钠,化学反应方程式为 。要清洗附着在试管壁上的硫,可用的试剂是 。
(2)如图为钠高能电池的结构示意图,该电池的工作温度为320 ℃左右,电池反应为2Na+xS=Na2Sx,正极的电极反应式为 。M(由Na2O和Al2O3制得)的两个作用是 。
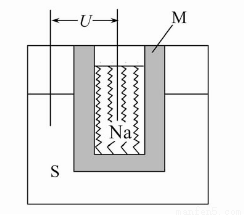
与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的 __ 倍。
(3)Na2S溶液中离子浓度由大到小的顺序为 ,向该溶液中加入少量固体CuSO4,溶液pH (填“增大”、“减小”或“不变”),Na2S溶液长期放置有硫析出,原因为 (用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 8-4难溶电解质的溶解平衡练习卷(解析版) 题型:选择题
下表列出了几种常见物质的电离常数或溶度积:
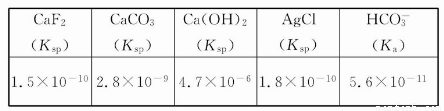
在一定量的0.2 mol/L CaCl2溶液中加入等体积的下列溶液,可以产生沉淀的是( )
A.由水电离出的c(H+)=10-9 mol/L的HF溶液
B.pH=10的氨水
C.1 mol/L的NaHCO3溶液
D.10-9 mol/L的AgNO3溶液
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 8-1弱电解质的电离练习卷(解析版) 题型:选择题
0.1 mol·L-1氨水10 mL,加蒸馏水稀释到1 L后,下列变化中正确的是( )
①电离程度增大;②c(NH3·H2O)增大;③NH4+数目增多;④c(OH-)增大;⑤导电性增强;⑥ 增大
增大
A.①②③ B.①③⑤ C.①③⑥ D.②④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com