
ТСЦЄCuSO4ИЬТє·Ц±рУлNa2CO3ИЬТєЎўNa2SИЬТєµД·ґУ¦ЗйїцИзПВЈє
(1)CuSO4+Na2CO3
ЦчТЄЈєCu2++CO32-+H2O=Cu(OH)2Ўэ+CO2Ўь
ґОТЄЈєCu2++CO32-=CuCO3Ўэ(јёєхІ»·ўЙъ·ґУ¦ЎЈПВН¬)
(2)CuSO4+Na2S
ЦчТЄЈєCu2++S2-=CuSЎэ
ґОТЄЈєCu2++S2-+2H2O=Cu(OH)2Ўэ+H2SЎь
ФтПВБРјёЦЦОпЦКµДИЬЅв¶ИґуРЎµД±ИЅПЦРЈ¬ХэИ·µДКЗ( )
AЈ®CuSЈјCu(OH)2ЈјCuCO3
BЈ®CuSЈѕCu(OH)2ЈѕCuCO3
CЈ®Cu(OH)2ЈѕCuCO3ЈѕCuS
DЈ®Cu(OH)2ЈјCuCO3ЈјCuS

| Дкј¶ | ёЯЦРїОіМ | Дкј¶ | іхЦРїОіМ |
| ёЯТ» | ёЯТ»Гв·СїОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СїОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СїОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СїОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СїОіМНЖјцЈЎ | іхИэ | іхИэГв·СїОіМНЖјцЈЎ |
їЖДїЈєёЯЦР»ЇС§ АґФґЈє2014Дк»ЇС§ёЯїјїОК±СЭБ·10јЧНйТТП©±ЅГєКЇУНМмИ»ЖшµДЧЫєПАыУГБ·П°ѕнЈЁЅвОц°жЈ© МвРНЈєСЎФсМв
ПВБРУлУР»ъОпЅб№№ЎўРФЦКПа№ШµДРрКцґнОуµДКЗ( )
A.ТТЛб·ЦЧУЦРє¬УРфИ»щЈ¬їЙУлNaHCO3ИЬТє·ґУ¦ЙъіЙCO2
B.µ°°ЧЦКєНУНЦ¬¶јКфУЪёЯ·ЦЧУ»ЇєПОпЈ¬Т»¶ЁМхјюПВДЬЛ®Ѕв
C.јЧНйєНВИЖш·ґУ¦ЙъіЙТ»ВИјЧНйЈ¬±ЅєНПхЛб·ґУ¦ЙъіЙПх»щ±ЅµД·ґУ¦АаРНПаН¬
D.±ЅІ»ДЬК№деµДЛДВИ»ЇМјИЬТєНКЙ«Ј¬ЛµГч±Ѕ·ЦЧУЦРГ»УРУлТТП©·ЦЧУЦРАаЛЖµДМјМјЛ«јь
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє2014Дк»ЇС§ёЯїјЧЬёґП°їОК±СЭБ·3-4ЅрКфІДБПУГНѕ ЅрКфїуОпАыУГБ·П°ѕнЈЁЅвОц°жЈ© МвРНЈєСЎФсМв
ПВБРУР№ШґїМъµДРрКцХэИ·µДКЗЈЁ Ј©
AЈ®ИЫµг±ИЙъМъµДµН
BЈ®УлПаН¬ЕЁ¶ИµДСОЛб·ґУ¦ЙъіЙЗвЖшµДЛЩВК±ИЙъМъµДїм
CЈ®ФЪАдµДЕЁБтЛбЦРїЙТФ¶Ы»Ї
DЈ®ФЪі±КЄїХЖшЦР±ИЙъМъИЭТЧ±»ёЇКґ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє2014Дк»ЇС§ёЯїјЧЬёґП°їОК±СЭБ· 9-1ФµзіШ »ЇС§µзФґБ·П°ѕнЈЁЅвОц°жЈ© МвРНЈєСЎФсМв
СРѕїИЛФ±СРЦЖіцТ»ЦЦп®Л®µзіШЈ¬їЙЧчОЄУгАЧєНЗ±Н§µДґў±ёµзФґЎЈёГµзіШТФЅрКфп®єНёЦ°еОЄµзј«ІДБПЈ¬ТФLiOHОЄµзЅвЦКЈ¬К№УГК±јУИлЛ®јґїЙ·ЕµзЎЈ№ШУЪёГµзіШµДПВБРЛµ·ЁІ»ХэИ·µДКЗ( )
A.Л®јИКЗСх»ЇјБУЦКЗИЬјБ
B.·ЕµзК±Хэј«ЙПУРЗвЖшЙъіЙ
C.·ЕµзК±OH-ПтХэј«ТЖ¶Ї
D.ЧЬ·ґУ¦ОЄ:2Li+2H2O=2LiOH+H2Ўь
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє2014Дк»ЇС§ёЯїјЧЬёґП°їОК±СЭБ· 8-4ДСИЬµзЅвЦКµДИЬЅвЖЅєвБ·П°ѕнЈЁЅвОц°жЈ© МвРНЈєСЎФсМв
ПВ±нБРіцБЛјёЦЦіЈјыОпЦКµДµзАліЈКэ»тИЬ¶И»эЈє
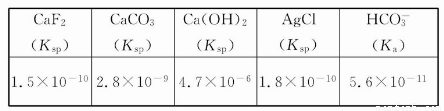
ФЪТ»¶ЁБїµД0.2 molЈЇL CaCl2ИЬТєЦРјУИлµИМе»эµДПВБРИЬТєЈ¬їЙТФІъЙъіБµнµДКЗ( )
AЈ®УЙЛ®µзАліцµДc(HЈ«)=10Ј9 mol/LµДHFИЬТє
BЈ®pHЈЅ10µД°±Л®
CЈ®1 molЈЇLµДNaHCO3ИЬТє
DЈ®10-9 molЈЇLµДAgNO3ИЬТє
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє2014Дк»ЇС§ёЯїјЧЬёґП°їОК±СЭБ· 8-3СОАаµДЛ®ЅвБ·П°ѕнЈЁЅвОц°жЈ© МвРНЈєСЎФсМв
ТСЦЄДіОВ¶ИПВCH3COOHµДµзАліЈКэK=1.6ЎБ10-5ЎЈёГОВ¶ИПВПт20 mL 0.01 mol/L CH3COOHИЬТєЦРЦрµОјУИл0.01 mol/L KOHИЬТєЈ¬ЖдpH±д»ЇЗъПЯИзНјЛщКѕ(єцВФОВ¶И±д»Ї)ЎЈЗл»ШґрПВБРУР№ШОКМвЈє
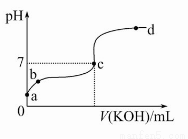
(1)aµгИЬТєЦРc(H+)ОЄ ЎЈ
(2)bµгИЬТєЦРАлЧУЕЁ¶ИґуРЎЛіРтОЄ »т »т ЎЈcµгИЬТєЦРµДАлЧУЕЁ¶ИґуРЎЛіРтОЄ ЎЈ
(3)aЎўbЎўcИэµгЦРЛ®µДµзАліМ¶ИЧоґуµДКЗ Ј¬µО¶Ё№эіМЦРТЛСЎУГ ЧчЦёКѕјБЎЈ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє2014Дк»ЇС§ёЯїјЧЬёґП°їОК±СЭБ· 8-3СОАаµДЛ®ЅвБ·П°ѕнЈЁЅвОц°жЈ© МвРНЈєСЎФсМв
ФЪ0.1 mol/LµДґЧЛбДЖИЬТєЦРјУИлµИМе»эµДПВБРОпЦКЈ¬ИЬТєЦРАлЧУЕЁ¶ИґуРЎ№ШПµХэИ·µДКЗ( )
A.Л®Ј»c(CH3COO-)Јѕc(Na+)Јѕc(OH-)Јѕc(H+)
B.0.1 mol/LСОЛбЈ»c(Na+)=c(Cl-)Јѕc(H+)Јѕc(CH3COO-)Јѕc(OH-)
C.0.1 mol/LґЧЛбЈ»c(Na+)Јѕc(CH3COO-)Јѕc(H+)Јѕc(OH-)
D.0.1 mol/LЗвСх»ЇДЖЈ»c(Na+)Јѕc(CH3COO-)Јѕc(OH-)Јѕc(H+)
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє2014Дк»ЇС§ёЯїјЧЬёґП°їОК±СЭБ· 8-1ИхµзЅвЦКµДµзАлБ·П°ѕнЈЁЅвОц°жЈ© МвРНЈєКµСйМв
јЧЎўТТБЅО»Н¬С§ЙијЖУГКµСйИ·¶ЁДіЛбHAКЗИхµзЅвЦКЈ¬ґжФЪµзАлЖЅєвЈ¬ЗТёД±дМхјюЖЅєв·ўЙъТЖ¶ЇЎЈКµСй·Ѕ°ёИзПВЈє
јЧЈєИЎґї¶ИПаН¬Ј¬ЦКБїЎўґуРЎПаµИµДРїБЈУЪБЅЦ§КФ№ЬЦРЈ¬Н¬К±јУИл 0.1 molЎ¤L-1µДHAИЬТєЎўПЎСОЛбёч10 mLЈ¬°ґНјЧ°єГЈ¬№ЫІмПЦПуЎЈ
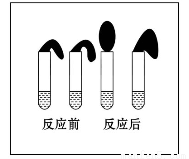
ТТЈєўЩ УГpHјЖІв¶ЁЕЁ¶ИѕщОЄ0.1 molЎ¤L-1 µДHAИЬТєєНПЎСОЛбµДpHЈ»
ўЪ ФЩИЎ0.1 molЎ¤L-1µДHAИЬТєєНПЎСОЛбёч2µО(1µОФјОЄ1/20 mL)·Ц±рПЎКНЦБ100 mLЈ¬ФЩУГpHјЖІвЖдpH±д»ЇЎЈ
(1)ТТµД·Ѕ°ёЦРЛµГчHAКЗИхµзЅвЦКµДАнУЙКЗЈєІвµГ0.1 molЎ¤L-1µДHAИЬТєµД
pH 1(МоЎ°ЈѕЎ±ЎўЎ°ЈјЎ±»тЎ°=Ў±)Ј»јЧ·Ѕ°ёЦРЈ¬ЛµГчHAКЗИхµзЅвЦКµДКµСйПЦПуКЗЈє
(МоРтєЕ)
A.јУИлБЅЦЦПЎЛбєуЈ¬БЅёцКФ№ЬЙП·ЅµДЖшЗтН¬К±№ДЖрЈ¬ЗТТ»Сщґу
B.јУИлHAИЬТєєуЈ¬КФ№ЬЙП·ЅµДЖшЗт№ДЖрВэ
C.јУИлПЎСОЛбєуЈ¬КФ№ЬЙП·ЅµДЖшЗт№ДЖрВэ
(2) ТТН¬С§ЙијЖµДКµСйµЪ ІЅЈ¬ДЬЦ¤ГчёД±дМхјюИхµзЅвЦКЖЅєв·ўЙъТЖ¶ЇЎЈјЧН¬С§ОЄБЛЅшТ»ІЅЦ¤ГчИхµзЅвЦКµзАлЖЅєвТЖ¶ЇµДЗйїцЈ¬ЙијЖИзПВКµСйЈє
ўЩК№HAµДµзАліМ¶ИєНc(H+)¶јјхРЎЈ¬c(A-)ФцґуЈ¬їЙФЪ0.1 molЎ¤L-1µДHAИЬТєЦРЈ¬СЎФсјУИл КФјБ(СЎМоЎ°AЎ±ЎўЎ°BЎ±ЎўЎ°CЎ±»тЎ°DЎ±,ПВН¬)Ј»
ўЪК№HAµДµзАліМ¶ИјхРЎЈ¬c(H+)єНc(A-)¶јФцґуЈ¬їЙФЪ0.1 molЎ¤L-1µДHAИЬТєЦРЈ¬СЎФсјУИл КФјБЎЈ
A.NaA№ММе(їЙНкИ«ИЬУЪЛ®)
B.1 molЎ¤L-1 NaOHИЬТє
C.1 molЎ¤L-1 H2SO4
D.2 molЎ¤L-1 HA
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє2014Дк»ЇС§ёЯїјЧЬёґП°їОК±СЭБ· 6»ЇС§·ґУ¦УлДЬБїБ·П°ѕнЈЁЅвОц°жЈ© МвРНЈєМоїХМв
µЅДїЗ°ОЄЦ№Ј¬УЙ»ЇС§ДЬЧЄ±дОЄИИДЬ»тµзДЬИФИ»КЗИЛАаК№УГЧоЦчТЄµДДЬФґЎЈ
ЈЁ1Ј©»ЇС§·ґУ¦ЦР·ЕіцµДИИДЬЈЁмК±дЈ¬¦¤HЈ©Ул·ґУ¦ОпєНЙъіЙОпФЪ·ґУ¦№эіМЦР¶ПјьєНРОіЙРВјь№эіМЦРОьКХєН·ЕіцДЬБїµДґуРЎУР№ШЎЈ
ТСЦЄЈєH2ЈЁgЈ©Ј«Cl2ЈЁgЈ©=2HClЈЁgЈ© ¦¤HЈЅЈ185 kJ/molЈ¬¶ПБС1 mol HЎЄHјьОьКХµДДЬБїОЄ436 kJЈ¬¶ПБС1 mol ClЎЄClјьОьКХµДДЬБїОЄ247 kJЈ¬ФтРОіЙ1 mol HЎЄClјь·ЕіцµДДЬБїОЄ ЎЈ
ЈЁ2Ј©ИјБПИјЙХЅ«ЖдЛщє¬µД»ЇС§ДЬЧЄ±дОЄОТГЗЛщРиТЄµДИИДЬЎЈТСЦЄЈє
ўЩCH4ЈЁgЈ©Ј«2O2ЈЁgЈ©=CO2ЈЁgЈ©Ј«2H2OЈЁlЈ© ¦¤HЈЅЈ890Ј®3 kJЎ¤mol-1
ўЪCЈЁs,КЇД«Ј©Ј«O2ЈЁgЈ©=CO2ЈЁgЈ© ¦¤HЈЅЈ393Ј®5 kJЎ¤molЈ1
ўЫ2H2ЈЁgЈ©Ј«O2ЈЁgЈ©=2H2OЈЁlЈ© ¦¤HЈЅЈ571Ј®6 kJЎ¤mol-1
±кЧјЧґїцПВ22Ј®4 LЗвЖшєНјЧНйµД»мєПЖшМеФЪЧгБїµДСхЖшЦРід·ЦИјЙХ·ґУ¦·Еіц588Ј®05 kJµДИИБїЈ¬Ф»мєПЖшМеЦРЗвЖшµДЦКБїКЗ ЎЈёщѕЭТФЙПИэёцИИ»ЇС§·ЅіМКЅЈ¬јЖЛгCЈЁs,КЇД«Ј©Ј«2H2ЈЁgЈ©=CH4ЈЁgЈ©µД·ґУ¦ИИ¦¤HОЄ ЎЈ
Ійїґґр°ёєНЅвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБР±н - КФМвБР±н
єю±±КЎ»ҐБЄНшОҐ·ЁєНІ»БјРЕПўѕЩ±ЁЖЅМЁ | НшЙПУРє¦РЕПўѕЩ±ЁЧЁЗш | µзРЕХ©ЖѕЩ±ЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРє¦РЕПўѕЩ±ЁЧЁЗш | ЙжЖуЗЦИЁѕЩ±ЁЧЁЗш
ОҐ·ЁєНІ»БјРЕПўѕЩ±Ёµз»°Јє027-86699610 ѕЩ±ЁУКПдЈє58377363@163.com