
到目前为止,由化学能转变为热能或电能仍然是人类使用最主要的能源。
(1)化学反应中放出的热能(焓变,ΔH)与反应物和生成物在反应过程中断键和形成新键过程中吸收和放出能量的大小有关。
已知:H2(g)+Cl2(g)=2HCl(g) ΔH=-185 kJ/mol,断裂1 mol H—H键吸收的能量为436 kJ,断裂1 mol Cl—Cl键吸收的能量为247 kJ,则形成1 mol H—Cl键放出的能量为 。
(2)燃料燃烧将其所含的化学能转变为我们所需要的热能。已知:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
②C(s,石墨)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
③2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
标准状况下22.4 L氢气和甲烷的混合气体在足量的氧气中充分燃烧反应放出588.05 kJ的热量,原混合气体中氢气的质量是 。根据以上三个热化学方程式,计算C(s,石墨)+2H2(g)=CH4(g)的反应热ΔH为 。
(1)434 kJ (2)1.0 g -74.8 kJ/mol
【解析】解答本题时应注意以下两点:
(1)根据ΔH=旧键断裂吸收的能量-新键形成放出的能量,可以求断键或成键吸收或放出的能量。
(2)根据求解的反应C(s,石墨)+2H2(g)=CH4(g),找出可用的已知热化学方程式①②③,然后将热化学方程式进行相应的调整,然后进行加和即得。
(1)H2(g)+Cl2(g)=2HCl(g) ΔH=-185 kJ/mol ,该反应的ΔH=旧键断裂吸收的能量-新键形成放出的能量,设形成1 mol H—Cl键放出的能量为x,则每发生这样的反应1 mol,ΔH=436 kJ·mol-1+247 kJ·mol-1-2x=-185 kJ·mol-1,解得x=434 kJ·mol-1,所以每形成1 mol H—Cl键放出
434 kJ的热量。
(2)设混合气体中CH4的物质的量为a,H2的物质的量为b,a+b=1 mol
890.3 kJ·mol-1×a+571.6 kJ·mol-1×b/2=588.05 kJ,解得a=0.5 mol,b=0.5 mol,所以H2的质量为0.5 mol×2 g·mol-1=1.0 g。
根据反应C(s,石墨)+2H2(g)=CH4(g)可知,②+③-① 即得,所以该反应的反应热为ΔH=-571.6 kJ·mol-1-393.5 kJ·mol-1+890.3 kJ·mol-1
=-74.8 kJ·mol-1。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014年化学高考总复习课时演练 8-4难溶电解质的溶解平衡练习卷(解析版) 题型:选择题
已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3
主要:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑
次要:Cu2++CO32-=CuCO3↓(几乎不发生反应。下同)
(2)CuSO4+Na2S
主要:Cu2++S2-=CuS↓
次要:Cu2++S2-+2H2O=Cu(OH)2↓+H2S↑
则下列几种物质的溶解度大小的比较中,正确的是( )
A.CuS<Cu(OH)2<CuCO3
B.CuS>Cu(OH)2>CuCO3
C.Cu(OH)2>CuCO3>CuS
D.Cu(OH)2<CuCO3<CuS
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 8-1弱电解质的电离练习卷(解析版) 题型:选择题
甲酸的下列性质中,可以证明它是弱电解质的是( )
A.1 mol / L甲酸溶液的c(H+)=0.01 mol/L
B.甲酸能与水以任何比例互溶
C.10 mL 1 mol/L甲酸恰好与10 mL 1 mol/L NaOH溶液完全反应
D.甲酸溶液的导电性比盐酸的弱
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 7-1化学反应速率及影响因素练习卷(解析版) 题型:选择题
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得图,则曲线a、b、c、d所对应的实验组别可能是( )

A.4-3-2-1 B.1-2-3-4
C.3-4-2-1 D.1-2-4-3
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 7-1化学反应速率及影响因素练习卷(解析版) 题型:选择题
对于反应2SO2(g)+O2(g) 2SO3(g)能增大正反应速率的措施是( )
2SO3(g)能增大正反应速率的措施是( )
A.通入大量O2 B.增大容器容积
C.移去部分SO2 D.降低体系温度
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 6化学反应与能量练习卷(解析版) 题型:选择题
在一定条件下,充分燃烧一定量的丁烷,放出热量为
Q kJ(Q>0),经测定完全吸收生成的二氧化碳需要消耗5 mol·L-1的KOH溶液100 mL,恰好生成正盐,则此条件下反应C4H10(g)+ O2(g)=4CO2(g)+5H2O(g)的ΔH为( )
O2(g)=4CO2(g)+5H2O(g)的ΔH为( )
A.+8Q kJ·mol-1 B.-8Q kJ·mol-1
C.+16Q kJ·mol-1 D.-16Q kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 5-3化学键练习卷(解析版) 题型:简答题
短周期主族元素A、B、C、D、E、F 的原子序数依次增大,它们的原子核外电子层数之和为13。B的化合物种类繁多,数目庞大;C、D是空气中含量最多的两种元素,D、E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素。试回答以下问题:
(1)写出D与E以1∶1的原子个数比形成的化合物的电子式: _____ 。F的原子结构示意图为: 。
(2)B、D形成的化合物BD2中存在的化学键为 键(填“离子”或“共价”,下同)。A、C、F三种元素形成的化合物CA4F为 _____ 化合物。
(3)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性。则甲、乙反应的离子方程式为: 。
(4)A、C、D、E的原子半径由大到小的顺序是 (用元素符号表示)。
(5)元素B和F的非金属性强弱,B的非金属性 ____ 于F(填“强”或“弱”),并用化学方程式证明上述结论 。
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 5-2元素周期表 元素周期律练习卷(解析版) 题型:选择题
下表是部分短周期元素的原子半径及主要化合价,以下叙述正确的是( )
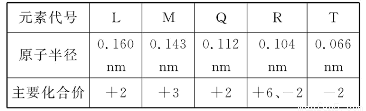
A.气态氢化物的稳定性为H2T<H2R
B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性
D.L2+与R2-的核外电子数相等
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 4-3硫及其重要化合物练习卷(解析版) 题型:选择题
下列有关硫及其化合物的说法正确的是( )
A.浓硫酸具有吸水性,因而能使蔗糖碳化
B.将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色
C.在反应SO2+2H2S=3S+2H2O中SO2作氧化剂
D. 硫粉在过量的纯氧中燃烧可以生成SO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com