
【题目】下面是元素周期表的一部分,参照元素①﹣⑧在表中的位置,请用化学用语回答下列问题:

(1)②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是(填化学式)____________________.
(2)在①、④、⑤、⑧中的某些元素之间可形成既含离子键又含非极性共价键的离子化合物,写出其中一种化合物的电子式: ______________________
(3)由②和④组成的化合物与⑤的同周期相邻主族元素的单质反应的化学方程式为:______________
(4)⑦单质与⑤的最高价氧化物的水化物反应的离子方程式为________________.
(5)常温下,由①②④组成最简单的液态有机物可作为燃料电池的原料之一,请写出其在碱性介质中的电极反应式:_________________________________
【答案】HClO4>H2CO3>H2SiO3 ![]() 2Mg+CO2
2Mg+CO2![]() 2MgO+C Si+2OH-+H2O=SiO32-+2H2↑ CH3OH+8OH﹣﹣6e﹣=CO32﹣+4H2O
2MgO+C Si+2OH-+H2O=SiO32-+2H2↑ CH3OH+8OH﹣﹣6e﹣=CO32﹣+4H2O
【解析】
根据元素周期表短周期元素的结构和性质分析解答;根据元素周期律的应用分析解答;根据燃料电池的原理分析解答。
从元素周期表中可知:①H②C③N④O⑤Na⑥Al⑦Si⑧Cl
(1) ②、⑦、⑧的最高价含氧酸分别是:H2CO3、H2SiO3、HClO4,酸性由强到弱的顺序是HClO4>H2CO3>H2SiO3;
(2) ①、④、⑤、⑧中的某些元素之间可形成既含离子键又含非极性共价键的离子化合物可以是NaOH,也可以是Na2O2,电子式为:![]()
![]() ;
;
(3) ⑤的同周期相邻主族元素的单质是Mg,②和④组成的化合物是CO2,发生的化学反应方程式为:2Mg+CO2![]() 2MgO+C;
2MgO+C;
(4) ⑦单质是Si,⑤的最高价氧化物的水化物是NaOH,他们发生复分解反应为:Si+2NaOH+H2O=Na2SiO3+2H2↑,离子反应方程式为:Si+2OH-+H2O=SiO32-+2H2↑;
(5) ①②④分别是H、C、O,形成最简单液态有机物可作为燃料电池的原料之一,该有机物为:CH3OH,它在碱性条件下,作负极反应物,失去电子,故电极方程式为:CH3OH+8OH﹣﹣6e﹣=CO32﹣+4H2O。


 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:
【题目】药物吗替麦考酚酯有强大的抑制淋巴细胞增殖的作用,可通过如下反应制得:
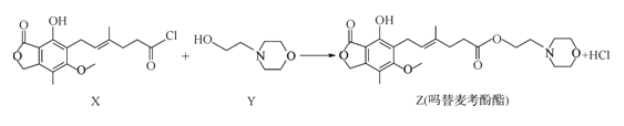
下列叙述正确的是
A. 化合物X的分子式为C17H18O5Cl
B. 化合物Y的属于α—氨基酸的同分异构体数目为4种
C. 1 mol化合物Z可以与4 mol NaOH反应
D. 用FeCl3溶液可鉴别化合物X和Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对CH4与CH3CH3的叙述错误的是
A. CH4与CH3CH3互为同系物
B. CH4与Cl2在光照下反应有四种产物
C. CH4与Cl2在光照下反应属于取代反应
D. CH3CH3与Cl2在光照下可以发生反应CH3CH3+Cl2![]() CH3CH2Cl+HCl
CH3CH2Cl+HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】福酚美克是一种影响机体免疫力功能的药物,可通过以下方法合成:
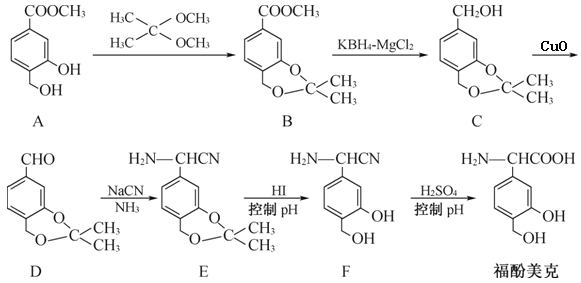
(1)A中的含氧官能团有____和____(填名称)。
(2)写出C→D的转化的化学方程式____,该反应属于____(填反应类型)。
(3)流程中设置A→B、E→F的目的是____。
(4)A的一种同分异构体X满足下列条件:
① X分子中有4种不同化学环境的氢
② X能与FeCl3溶液发生显色反应
③ 1 mol X最多能与4 mol NaOH发生反应
写出该同分异构体的结构简式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+的反应,他们使用的药品和装置如下图所示,下列说法不合理的是( )

A. 能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
B. 装置C的作用是吸收多余的SO2,防止污染空气
C. 为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2,产生白色沉淀
D. 为了验证A中发生了氧化还原反应,加入酸性KMnO4溶液,紫红色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在相应的条件下可能大量共存的是( )
A. 能使pH试纸变红的溶液中:CO32—、K+、Cl-、Na+
B. 由水电离产生的c(OH-)=1×10-10mol·L-1的溶液中:NO3—、Mg2+、Na+、SO42—
C. 在![]() =1×1012的溶液中:NH4+、Fe2+、Cl-、NO3—
=1×1012的溶液中:NH4+、Fe2+、Cl-、NO3—
D. ![]() =10-14mol·L-1的溶液中:Na+、HCO3—、Cl-、K+
=10-14mol·L-1的溶液中:Na+、HCO3—、Cl-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O的反应中被还原的硝酸与未被还原的硝酸分子个数比为 ( )
A. 1∶9 B. 9∶1 C. 4∶2 D. 2∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为H2与O2反应生成H2O(g)的能量变化示意图,下列有关叙述不正确的是

A. 1 mol H2分子断键需要吸收436 kJ的能量
B. H2(g)+1/2O2(g)=H2O(g) ΔH=-241.8 kJ/mol
C. 反应物的总能量高于生成物的总能量
D. 形成化学键释放的总能量比断裂化学键吸收的总能量小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列可设计成原电池的化学反应是( )
A. H2O(l)+CaO(s)=Ca(OH)2(s)
B. Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3·H2O+8H2O
C. 2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
D. CH4(g)+2O2(g) ![]() CO2(g)+2H2O(l)
CO2(g)+2H2O(l)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com