
【题目】用下图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是

A. 用石墨作阳极,铁作阴极
B. 阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O
C. 阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH-
D. 除去CN-的反应:2CN-+ 5ClO- + 2H+ = N2↑ + 2CO2↑ + 5Cl-+ H2O
科目:高中化学 来源: 题型:
【题目】将25.6gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.4mol,这些气体恰好能被500mL 1mol/LNaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,其中NaNO3的物质的量为( )
A. 0.2molB. 0.1molC. 0.4molD. 0.3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下等质量的SO2和CO2相比较,下列各项正确的是( )
A. 原子个数之比为1:1B. 物质的量之比为1:1
C. 体积之比为11:16D. 分子数之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色溶液中能大量共存的是( )
A.K+、OH-、H+B.Na+、Ca2+、CO32-
C.Na+、SO42-、Cl-D.Al3+、NO3-、Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温条件下,可逆反应:2NO(g)+O2(g)![]() 2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2②单位时间内生成n mol O2的同时生成2n mol NO③用NO2、NO、O2表示的反应速率的比为2:2:1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态.
A. ①④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以石墨为电极分别电解硫酸钠溶液和饱和食盐水,关于两个电解池反应的说法正确的是( )
A. 阳极反应式相同
B. 电解结束后所得液体的pH相同
C. 阴极反应式相同
D. 通过相同电量时生成的气体总体积相等(同温同压)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质分类正确的是( )
A.Al(OH)3难溶于水,不属于电解质B.H2SiO3、H2SO3都是弱酸
C.Na2O2为碱性氧化物D.浓硫酸、液氯均属于分散系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积为2 L的密闭容器中充入2 mol X,一定条件下可发生反应:2X(g)![]() 3Y(g),该反应的反应速率(v)与时间(t)的关系如图所示,已知t2 min时容器内有1.5 mol Y。下列叙述正确的是( )
3Y(g),该反应的反应速率(v)与时间(t)的关系如图所示,已知t2 min时容器内有1.5 mol Y。下列叙述正确的是( )
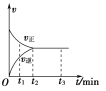
A. t1 min时,只有正反应发生
B. t2~t3 min内,v(X)正=0,反应已经停止
C. 0~t2 min内,v(X)=![]() mol·L-1·min-1
mol·L-1·min-1
D. 若t3 min时升高温度,则反应速率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用软锰矿(主要成分MnO2)和黄铁矿(主要成分FeS2) 制取MnSO4·H2O并回收单质硫的工艺流程如下:
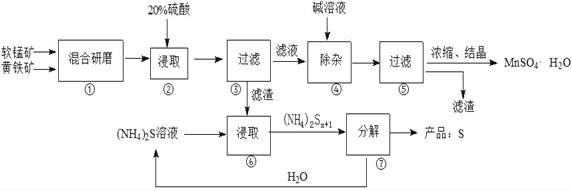
已知:本实验条件下,高锰酸钾溶液与硫酸锰溶液混合产生二氧化锰。
回答下列问题:
(1)步骤①混合研磨成细粉的主要目的是_____________________________________________;步骤②浸取时若生成S、MnSO4及Fe2(SO4)3的化学方程式为_____________________________________。
(2)步骤③所得酸性滤液可能含有Fe2+,为了除去Fe2+可先加入______________________;步骤④需将溶液加热至沸然后在不断搅拌下加入碱调节pH为4~5,再继续煮沸一段时间,“继续煮沸”的目的是_____________________________________。步骤⑤所得滤渣为__________________(填化学式)。
(3)步骤⑦需在90~100℃下进行,该反应的化学方程式为_________________________________。
(4)测定产品MnSO4·H2O的方法之一是:准确称取a g产品于锥形瓶中,加入适量ZnO及H2O煮沸,然后用c mol·L-1KMnO4标准溶液滴定至浅红色且半分钟不褪色,消耗标准溶液VmL,产品中Mn2+的质量分数为w(Mn2+)=________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com