
某小组通过实验研究Na2O2与水的反应?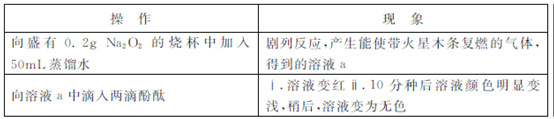
(1)Na2O2与水反应的化学方程式是 ?
(2)ⅱ中溶液褪色可能是溶液a中存在较多的H2O2,H2O2与酚酞发生了反应?
Ⅰ.甲同学通过实验证实了H2O2的存在:取少量溶液a,加入试剂 (填化学式),有气体产生?
Ⅱ.乙同学查阅资料获悉:用KMnO4(被还原为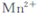 )可以测定H2O2的含量?
)可以测定H2O2的含量?
取3mL溶液a稀释至15mL,用稀H2SO4酸化,再逐滴加入0.0045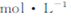 KMnO4溶液,产生气体,溶液褪色速率开始较慢后变快,至终点时共消耗10mL KMnO4溶液?
KMnO4溶液,产生气体,溶液褪色速率开始较慢后变快,至终点时共消耗10mL KMnO4溶液?
①KMnO4与H2O2反应的离子方程式是 ?
②溶液a中 ?
?
③溶液褪色速率开始较慢后变快的原因可能是 ?
(3)为探究现象ⅱ产生的原因,同学们继续进行了如下实验:
Ⅰ.向H2O2溶液中滴入两滴酚酞,振荡,加入5滴0.1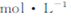 NaOH溶液,溶液变红又迅速变无色且产生气体,10分钟后溶液变无色,该过程无明显热效应?
NaOH溶液,溶液变红又迅速变无色且产生气体,10分钟后溶液变无色,该过程无明显热效应?
Ⅱ.向0.1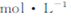 NaOH溶液中滴入两滴酚酞的,振荡,溶液变红,10分钟后溶液颜色无明显变化;向该溶液中通入氧气,溶液颜色无明显变化?从实验Ⅰ和Ⅱ中,可得出的结论是 ?
NaOH溶液中滴入两滴酚酞的,振荡,溶液变红,10分钟后溶液颜色无明显变化;向该溶液中通入氧气,溶液颜色无明显变化?从实验Ⅰ和Ⅱ中,可得出的结论是 ?
(1) 2Na2O2 + 2H2O ="4NaOH+" O2↑(2)Ⅰ.MnO2
Ⅱ.①2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O ②0.0375 ③反应生成的Mn2+作催化剂
(3)碱性条件下,H2O2能与酚酞反应而O2不能
解析试题分析:据题意可知过氧化钠与水反应生成了能使酚酞变红的碱性物质和能使带火星木条复燃的氧气,因此2Na2O2 + 2H2O ="4NaOH+" O2↑。双氧水在二氧化锰存在的条件下,可以分解为氧气和水,因此应加入的试剂为二氧化锰。高锰酸钾具有强氧化性可以把双氧水进行氧化生成氧气,因此2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O ,再据反应比例关系可知双氧水的浓度为0.0375摩尔每升。溶液褪色速率开始较慢后变快的原因可能是反应中生成了具有催化作用的锰离子。通过Ⅰ和Ⅱ可知在碱性条件下,双氧水能与酚酞反应而氧气不可以。
考点:主要考查过氧化钠与水反应的实验探究的相关知识点。


科目:高中化学 来源: 题型:填空题
某实验小组用工业废弃固体(主要成分为Cu2S和Fe2O3)制备有关物质,整个流程如下图所示。请回答: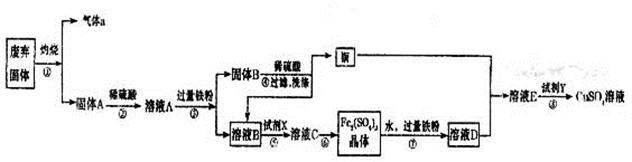
(1)气体a的化学式为 。
(2)溶液B加入硫酸酸化后再加入适宜氧化剂X得到溶液C,写出该反应的离子方程式 。
(3)制备硫酸铜溶液。常温下,O2、铜粉和稀硫酸三者在一起,几乎不反应,当加入溶液D后,随即生成硫酸铜。经理阅资料发现FeSO4对铜的氧化起催化作用。
A.第一步反应的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O,则第二步反应的郭子方程式为 。
B.⑦操作中,配制Fe2(SO4)3溶液时应注意 。
(4)操作⑧的目的是得到较纯的硫酸铜溶液。加入适宜试剂Y调节pH至铁元素全部沉淀(离子浓度小于10-5mol/L),然后再过滤,浓缩、结晶等,则pH至少调节为_____。
已知:Ksp[Cu(OH)2]≈1×10-22,Ksp[Fe(OH)2] ≈1×10-16,Ksp[Fe(OH)3] ≈1×10-38
(5)科学家发现纳米级的Cu2O在太阳光照射下可以催化分解水。
A.一定温度下,在2L密闭容器中加入纳米级Cu2O,通入2mol水蒸气,发生如下反应:
2H2O(g)=2H2(g)+O2(g) △H=+484kJ/mol
20min末测得n(O2)=0.16mol,则这段时间的反应速率υ(H2)=_________;该温度下,此反应的平衡常数表达式K=___________________。
B.已知:2Cu2O(s)+O2(g)=4CuO(s) △H=-292kJ/mol
2C(s)+O2(g)=2CO(g) △H=-221kJ/mol
请写出炭粉还原CuO(s)制备Cu2O(s)的热化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下: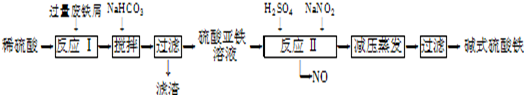
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
铁及其化合物在国民经济的发展中起着重要作用。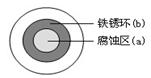
(1)已知:4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1641.0kJ·mol-1 C(石墨)+1/2O2(g)=CO(g) △H=-110.5 kJ·mol-1则Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)的△H= kJ·mol-1。
(2)铁在潮湿的空气中易发生电化学腐蚀。某同学将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。液滴边缘是 区(填“正极”或“负极”),其电极反应式为 。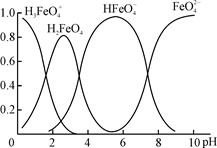
(3)铁钛合金是一种常用的不锈钢材料,某同学在探究该合金的性质时,往含有TiO2+、Fe3+溶液中加入铁屑至溶液显紫色,该过程中发生的反应有:
①2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
②Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
③ 。
(4)①高铁酸钾(K2FeO4)是一种优良的水处理剂。FeO在水溶液中的存在形态如右图所示,纵坐标表示各存在形态的分数分布。
下列说法不正确的是 。(填字母)
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:
HFeO+OH-=FeO+H2O
②K2FeO4溶于水会放出一种无色无味气体,其杀菌消毒、吸附水中的悬浮杂质的原理可用离子方程式表示为 。
(5)向一定量的Fe、FeO、Fe3O4的混合物中加入100 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,放出224 mL(标准状况)气体,加入KSCN溶液不显红色。若用足量的CO在高温下还原相同质量的此混合物,可得铁 g。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(12分)工业上用铝土矿(主要成分为Al2O3,Fe2O3等)提取Al2O3做冶炼铝的原料,由熔盐电解法获得的粗铝中含一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝。工艺流程如下图所示:
(已知:NaCl熔点为801℃;AlCl3在181℃升华)
(1)向滤液中通入过量CO2所发生反应的离子方程式为 。
(2)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,则铝和氧化铁反应的化学方程式为 。
(3)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮而除去。气泡的主要成分除Cl2外还含有______。固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在________。
(4)镀铝电解池中,金属铝为阳极,熔融盐电镀液中铝元素主要以AlCl4-形式存在,则阳极的电极反应式为_____________。
(5)钢材镀铝后,抗腐蚀性能会大大增强,其原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
铝镁合金是飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计了下列两种不同实验方案进行探究。填写下列空白:
【方案一】
【实验方案】将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
实验中发生反应的化学方程式是_____________________________。
【实验步骤】
(1)称取10.8 g铝镁合金粉末样品,溶于体??为V物质的量浓度为4.0 mol·L-1 NaOH溶液中,充分反应。则NaOH溶液的体积V≥_________mL。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将________(填“偏高”、“偏低”或“无影响”)。
【方案二】
【实验方案】将铝镁合金与足量稀硫酸溶液反应,测定生成气体的体积。
【实验步骤】
(1)同学们拟选用下列实验装置完成实验: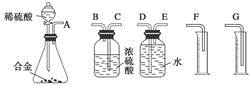
你认为最简易的装置其连接顺序是A接( )( )接( )( )接( )(填接口字母,可不填满)。
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了如图所示的实验装置。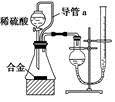
①装置中导管a的作用是_______________。
②实验前后量气管中液面读数分别为V1 mL、V2mL,则产生氢气的体积为___mL。
③若需确定产生氢气的量,还需测定的数据是______。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(15分)实验室以废铜屑为原料制取碱式碳酸铜【Cu2(OH)2CO3】的步骤如下:
步骤一:废铜屑制硝酸铜
如图,
用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。
步骤二:碱式碳酸铜的制备
向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70℃左右,用0.4 mol/L的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。
步骤三:碱式碳酸铜的组成测定
碱式碳酸铜可表示为:xCuCO3 ·yCu (OH)2 ·zH2O,可采用氢气还原法来确定,其反应原理为:
xCuCO3 ·yCu (OH)2 ·zH2O + H2→ Cu + CO2 + H2O(未配平)
完成下列填空:
(1)步骤一中,反应开始时,瓶内的现象是 ,
用该装置制取硝酸铜,好处是 。
(2)步骤二中,水浴加热所需仪器有 、 (加热、夹持仪器、石棉网除外);洗涤的目的是 。
(3) 步骤三中,①以字x、y、z母为系数,配平氢气还原法的化学方程式:
xCuCO3 ·yCu (OH)2 ·zH2O+ H2→ Cu+ CO2+ H2O
②称取24.0g某碱式碳酸铜样品,充分反应后得到12.8 g残留物,生成4.4g二氧化碳和7.2g水。该样品中结晶水质量为 g,化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某矿样含有大量的CuS及少量其它不溶于酸的杂质。实验室中以该矿样为原料制备CuCl2·2H2O晶体,流程如下: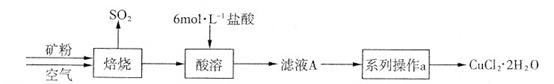
(1)在实验室中,欲用37%(密度为1.19 g·mL-1)的盐酸配制500 mL 6 mol·L-1的盐酸,需要的仪器除量筒、烧杯、玻璃棒外,还有 、 。
(2)①若在实验室中完成系列操作a。则下列实验操作中,不需要的是 (填下列各项中序号)。
②CuCl2溶液中存在如下平衡:Cu(H2O)42+(蓝色)+4Cl-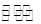 CuCl42-(黄色)+4H2O。
CuCl42-(黄色)+4H2O。
欲用实验证明滤液A(绿色)中存在上述平衡,除滤液A外,下列试剂中,还需要的是 (填下列各项中序号)。
a.FeCl3固体 b.CuCl2固体 c.蒸馏水
(3)某化学小组欲在实验室中研究CuS焙烧的反应过程,查阅资料得知在空气条件下焙烧CuS时,固体质量变化曲线及SO2生成曲线如下图所示。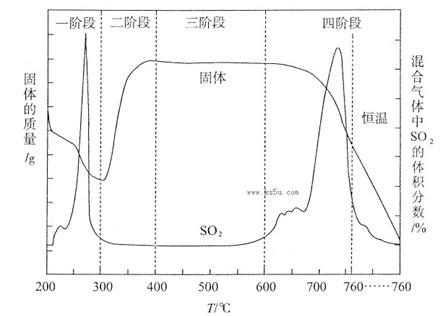
①CuS矿样在焙烧过程中,有Cu2S、CuO·CuSO4、CuSO4、CuO生成,转化顺序为:
第①步转化主要在200~300oC范围内进行,该步转化的化学方程式为 。
②300~400oC范围内,固体质量明显增加的原因是 ,上图所示过程中,CuSO4固体能稳定存在的阶段是 (填下列各项中序号)。
a.一阶段 b、二阶段 c、三阶段 d、四阶段
③该化学小组设计如下装置模拟CuS矿样在氧气中焙烧第四阶段的过程,并验证所得气体为SO2和O2的混合物。
a.装置组装完成后,应立即进行的一项操作是 。
b.当D装置中产生白色沉淀时,便能说明第四阶段所得气体为SO2和O2的混合物。你认为装置D中原来盛有的溶液为 溶液。
c.若原CuS矿样的质量为l0.0 g,在实验过程中,保持温度在760oC左右持续加热,待矿样充分反应后,石英玻璃管内所得固体的质量为8.0 g,则原矿样中CuS的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
一位学生对铁与氧化铁反应后的产物进行探究。
(1)提出假设
假设1:产物为FeO;
假设2:__________________。
(2)查阅资料
该学生通过查阅资料得知:在铁的三种氧化物中,四氧化三铁最稳定,氧化亚铁最不稳定,常温下极易被氧气氧化成氧化铁(颜色由黑色变成红色)。
通过查阅资料可以得出的初步结论为_________________________________。
(3)进行实验
该学生设计了如下装置进行铁与氧化铁反应的实验。请你帮助他将实验步骤补充完整。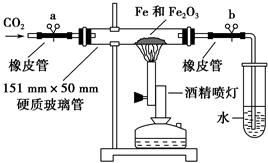
按如图装置连接好仪器(暂不装入药品),___________________ ____。
②称取1 g还原性铁粉和5 g氧化铁粉末,混合均匀后平摊在玻璃管中部。
③松开两个弹簧夹,_______________________________________________,
即可夹上弹簧夹a,并开始加热药品。
④大约4分钟左右,棕色粉末全部变黑;再夹上弹簧夹b,然后停止加热,等到玻璃管冷却至室温,倒出黑色粉末。
(4)现提供如下药品,验证实验得到的黑色粉末的成分。磁铁、稀盐酸、KSCN溶液、酸性KMnO4溶液、试管、胶头滴管。
| 实验步骤 | 预期现象和结论 |
| | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com