
【题目】下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积Kw | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a__1×10-14(填“>”“<”或“=”)。
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4mol·L-1,取该溶液1 mL加水稀释至10mL,则稀释后溶液中c(Na+)∶c(OH-)=__。
(3)在t2℃下pH=10的NaOH溶液中,水电离产生的OH-浓度c(OH-)水=__。
(4)t2℃下,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=__。
【答案】> 1000∶1 10-10mol·L-1 9∶11
【解析】
(1)电离为吸热过程,根据“越热越电离”的规律进行分析;
(2)注意中性溶液中,![]() 的浓度为
的浓度为![]() ,而硫酸根离子浓度醉着溶液体积的增大而减小。
,而硫酸根离子浓度醉着溶液体积的增大而减小。
(3)酸、碱均抑制水的电离,溶液中水电离产生的![]() 和
和![]() 的浓度均小于
的浓度均小于![]() ;
;
(4)混合后的溶液为酸性,所以![]() 过量,根据酸碱中和规律进行计算。
过量,根据酸碱中和规律进行计算。
(1)根据“越热越电离”的规律,a必定大于25℃下的离子积;
(2)硫酸钠中![]() 和
和![]() 是2:1的关系,溶液体积稀释到10倍,浓度会变为十分之一,因此稀释后
是2:1的关系,溶液体积稀释到10倍,浓度会变为十分之一,因此稀释后![]() 的浓度为
的浓度为![]() =10-4mol/,而中性溶液中
=10-4mol/,而中性溶液中![]() 的浓度为
的浓度为![]() ,二者为1000:1的关系;
,二者为1000:1的关系;
(3)酸、碱均抑制水的电离,所以先求出溶液中的![]() 和
和![]() 的浓度,谁小于
的浓度,谁小于![]() 谁就是水电离出来的,题目告知了
谁就是水电离出来的,题目告知了![]() 为
为![]() ,则水电离出的
,则水电离出的![]() 也为
也为![]() ;
;
(4)混合后的溶液为酸性,所以![]() 过量,首先根据pH不难算出硫酸中
过量,首先根据pH不难算出硫酸中![]() 为
为![]() ,
,![]() 溶液中
溶液中![]() 为
为![]() ,二者中和后剩余的
,二者中和后剩余的![]() 为
为![]() ,根据
,根据![]() 解得
解得![]() 。
。


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.麦芽糖及其水解产物均能发生银镜反应
B.用溴水即可鉴别苯酚溶液、2,4﹣己二烯和甲苯
C.在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH
D.用甘氨酸(![]() )和丙氨酸(
)和丙氨酸(![]() )缩合最多可形成4种二肽
)缩合最多可形成4种二肽
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的有
①![]() 该原子的电子排布图,最外层违背了洪特规则
该原子的电子排布图,最外层违背了洪特规则
②处于最低能量状态原子叫基态原子,1s22s22px1→1s22s22py1过程中形成的是发射光谱
③运用价层电子对互斥理论,CO32-离子的空间构型为三角锥型
④具有相同核外电子排布的粒子,化学性质相同
⑤NCl3中N-Cl键的键长比CCl4中C-Cl键的键长短
A.1个
B.2个
C.3个
D.4个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2O(l)=2H2(g)+O2(g) ΔH=+571.0kJ/mol。以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如下:
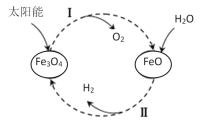
过程Ⅰ:2Fe3O4(s)=6FeO(s)+O2(g) ΔH=+313.2kJ/mol
过程Ⅱ:……
下列说法不正确的是( )
A.过程Ⅰ中每消耗232gFe3O4转移2mol电子
B.过程Ⅱ热化学方程式为:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH=-128.9kJ/mol
C.过程Ⅰ、Ⅱ中能量转化的形式依次是:太阳能→化学能→热能
D.铁氧化合物循环制H2具有成本低、产物易分离等优点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示:
CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示:
温度/℃ | 400 | 500 | 850 |
平衡常数 | 9.94 | 9 | 1 |
请回答下列问题:
(1)上述反应的化学平衡常数表达式为___,该反应的Q__0(填“>”或“<”)。
(2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g),发生上述反应,CO和H2O(g)浓度变化如图所示,则0~4 min时平均反应速率v(CO)=__。

(3)400℃时,压强恒定的密闭容器中进行上述反应。该可逆反应达到平衡的标志是__(填字母)。
A.v逆(H2)=v正(CO)
B.容器的总体积不再随时间而变化
C.混合气体的密度不再随时间变化
D.CO、H2O、CO2、H2的分子数之比为1∶1∶1∶1
(4)若在500℃时进行,且CO、H2O(g)的起始浓度均为0.020molL-1,该条件下,CO的最大转化率为__。
(5)若在850℃时进行,某时刻时测得CO(g)、H2O(g)、CO2(g)、H2(g)的物质的量分别为1mol、0.5mol、0.6mol、0.6mol,此时V正__V逆。(填“>”或“<”或“=”)
(6)若在850℃时进行,设起始时CO和H2O(g)共为1mol,其中水蒸气的体积分数为x,平衡时CO的转化率为y,试推导y随x变化的函数关系式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增加的X、Y、Z、W四种元素原子序数均小于36,Y基态原子最外层电子数是其内层电子总数的3倍,X、W基态原子是同周期元素中未成对电子数最多的原子,X与Z的原子核内质子数之和等于W原子核内质子数,Z基态原子只有1个未成对的电子。回答下列问题:
(1)已知化合物XZ3与H2Y(Y的氢化物)发生反应的化学方程式为XZ3+H2Y→XH3+HZY,则元素的电负性:Y______Z(填“大于”或“小于”),化合物HZY分子的空间构型为______。
(2)X的一种氢化物的相对分子质量为32,1mol该氢化物中的σ键数是______。
(3)①元素Y的一种单质分子与元素X、Y形成的一种离子互为等电子体,这两种微粒的化学式是_______、________。
②基态W原子的电子排布式是_______________。
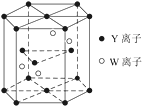
(4)元素Y和W的一种化合物的晶体结构如图所示,该晶体的化学式为______;金属原子______(选填“钾”、“镁”、“铜”)形成的晶体的堆积方式,与上述晶胞中Y离子的堆积方式相同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结构的研究是有机化学最重要的研究领域.某有机物X(C12H13O6Br)分子中含有多种官能团,其结构简式如下:(其中Ⅰ、Ⅱ为未知部分的结构).

为推测X的分子结构,进行如图转化:

已知向D的水溶液中滴入FeCl3溶液显紫色,对D的结构进行光谱分析,在氢核磁共振谱上显示只有两种信号.M、N互为同分异构体,M中含有一个六原子环,N能使溴的四氯化碳溶液褪色,G能与NaHCO3溶液反应.请回答:
(1)G分子所含官能团的名称是__;
(2)D不可以发生的反应有(选填序号)__;
①加成反应 ②消去反应 ③氧化反应 ④取代反应
(3)写出上图转化中反应①和②的化学方程式
①B+F→M__;
②G→N__;
(4)已知向X中加入FeCl3溶液,能发生显色反应,则X的结构简式是:___________,1mol该 X与足量的NaOH溶液作用,最多可消耗NaOH__mol;
(5)有一种化工产品的中间体W与G互为同分异构体,W的分子中只含有羧基、羟基和醛基三种官能团,且同一个碳原子上不能同时连有两个羟基.则W的分子结构有__种,写出任意一种的结构简式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释工业生产或应用的化学方程式正确的是( )
A.氯碱工业制氯气:2NaCl(熔融)![]() 2Na+C12↑
2Na+C12↑
B.利用磁铁矿冶炼铁:CO+FeO![]() Fe+CO2
Fe+CO2
C.工业制小苏打:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl
D.工业制粗硅:C+SiO2![]() Si+CO2↑
Si+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列关于NaOH溶液和氨水的说法正确的是( )
A.25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为20:1
B.pH=13的两溶液稀释100倍,pH都为11
C.两溶液中分别加入少量NH4Cl固体,c(OH )均减小
D.体积相同、pH相同的两溶液能中和等物质的量的盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com