解:(1)已知:①Fe
2O
3(S)+3C(s)
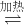
2Fe(s)+3CO(g)△H=-492.7kJ?mol
-1②3CO(g)+Fe
2O
3(s)
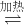
2Fe(s)+3CO
2(g)△H=+25.2kJ?mol
-1由盖斯定律,①+②得:2Fe
2O
3(s)+3C(s)
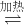
4Fe(s)+3CO
2(g);故△H=(-492.7kJ/mol)+25.2kJ/mol=-467.5kJ/mol;
故答案为:-467.5;
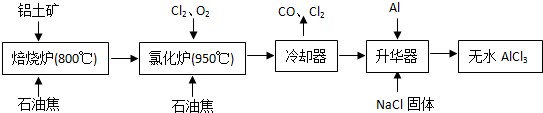
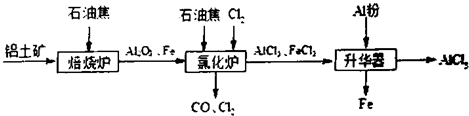
(2)①、根据工艺流程可知氯化炉的产物,经冷却、升华可制备无水AlCl
3,说明氯化炉的产物中含有A1C1
3,冷凝器尾气含有CO,所以Al
2O
3、C1
2和C反应,生成A1C1
3和CO,反应方程式为A1
2O
3+3C1
2+3C

2A1C1
3+3CO,反应中氯元素化合价由0价降低为-1价,氯气是氧化剂,故生成1mol AlCl
3时转移电子为1mol×3=3mol,
Cl
2有强氧化性,将SO
32-氧化为SO
42-,自身被还原为C1
-,反应离子方程式为SO
32-+C1
2+H
2O═SO
42-+2C1
-+2H
+,
由工艺流程可知,升华器中主要含有AlCl
3和FeCl
3,加入少量Al除去FeCl
3,Al与FeCl
3反应生成Fe、AlCl
3,反应方程式为Al+FeCl
3
AlCl
3+Fe,
由题目信息可知,AlCl
3的升华温度更低,应控制温度使AlCl
3升华,且FeCl
3不升华,故温度应控制在315℃以下,
故答案为:3;SO
32-+C1
2+H
2O═SO
42-+2C1
-+2H
+;Al+FeCl
3
AlCl
3+Fe;315℃;
②AlCl
3的水解,直接加热AlCl
3?6H
2O,水解彻底生成氢氧化铝,得不到氯化铝,浓硫酸吸水,同时可以生成HCl抑制氯化铝水解,利用浓硫酸的吸水性与难挥发性,
故答案为:c;
(3)该原电池实质是金属铝发生的吸氧腐蚀,氧气在正极放电生成氢氧根离子,电极反应式为O
2+4e
-+2H
2O=4OH
-,
电量相同,则原电池转移电子相同,令转移电子为3mol,则n(Al)=
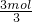
=1mol、n(Pb)=
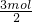
=1.5mol,故m(A1):m(Pb)=1mol×27g/mol:1.5mol×207g/mol=2:23
故答案为:O
2+4e
-+2H
2O=4OH
-;2:23.
分析:(1)由盖斯定律定律,①+②得:2Fe
2O
3(s)+3C(s)
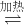
4Fe(s)+3CO
2(g);反应热也进行相应的计算;
(2)①根据工艺流程可知升华器中含有AlCl
3等,所以Al
2O
3、C1
2和C反应会生成A1C1
3,由冷凝器尾气可知还会生成CO,根据氯元素化合价变化计算注意电子数目;
Cl
2有强氧化性,将SO
32-氧化为SO
42-,自身被还原为C1
-;
由工艺流程可知,升华器中主要含有AlCl
3和FeCl
3,加入少量Al除去FeCl
3,Al与FeCl
3反应生成Fe、AlCl
3;
由题目信息可知,AlCl
3的升华温度更低,应控制温度使AlCl
3升华,且FeCl
3不升华;
②AlCl
3的水解,直接加热AlCl
3?6H
2O,水解彻底生成氢氧化铝,得不到氯化铝,浓硫酸吸水,同时可以生成HCl抑制氯化铝水解;
(3)该原电池实质是金属铝发生的吸氧腐蚀,氧气在正极放电生成氢氧根离子;
电量相同,则原电池转移电子相同,令转移电子为3mol,根据元素化合价计算n(Al)、n(Pb),再根据m=nM计算.
点评:本题考查反应热的计算、对工艺流程的理解与条件控制、盐类水解、原电池、化学计算等,难度中等,理解工艺流程是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础,对学生的分析问题、解决问题的能力有较高要求.


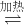 2Fe(s)+3CO(g)△H=-492.7kJ?mol-1
2Fe(s)+3CO(g)△H=-492.7kJ?mol-1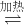 2Fe(s)+3CO2(g)△H=+25.2kJ?mol-1
2Fe(s)+3CO2(g)△H=+25.2kJ?mol-1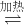 4Fe(s)+3CO2(g)△H=______kJ?mol-1
4Fe(s)+3CO2(g)△H=______kJ?mol-1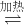 2Fe(s)+3CO(g)△H=-492.7kJ?mol-1
2Fe(s)+3CO(g)△H=-492.7kJ?mol-1 2Fe(s)+3CO2(g)△H=+25.2kJ?mol-1
2Fe(s)+3CO2(g)△H=+25.2kJ?mol-1 4Fe(s)+3CO2(g);故△H=(-492.7kJ/mol)+25.2kJ/mol=-467.5kJ/mol;
4Fe(s)+3CO2(g);故△H=(-492.7kJ/mol)+25.2kJ/mol=-467.5kJ/mol; 2A1C13+3CO,反应中氯元素化合价由0价降低为-1价,氯气是氧化剂,故生成1mol AlCl3时转移电子为1mol×3=3mol,
2A1C13+3CO,反应中氯元素化合价由0价降低为-1价,氯气是氧化剂,故生成1mol AlCl3时转移电子为1mol×3=3mol, AlCl3+Fe,
AlCl3+Fe, AlCl3+Fe;315℃;
AlCl3+Fe;315℃;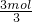 =1mol、n(Pb)=
=1mol、n(Pb)=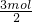 =1.5mol,故m(A1):m(Pb)=1mol×27g/mol:1.5mol×207g/mol=2:23
=1.5mol,故m(A1):m(Pb)=1mol×27g/mol:1.5mol×207g/mol=2:23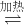 4Fe(s)+3CO2(g);反应热也进行相应的计算;
4Fe(s)+3CO2(g);反应热也进行相应的计算;

 阅读快车系列答案
阅读快车系列答案