
【题目】在一定温度下,对可逆反应4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),下列叙述中错误的是( )
4NO(g)+6H2O(g),下列叙述中错误的是( )
A.生成NO的速率与消耗NO的速率相等,反应达到平衡状态
B.当O2物质的量浓度不再变化时,反应达到平衡状态
C.达到化学平衡时,若升高温度,则正反应速率增大,逆反应速率也增大
D.单位时间内生成x mol NO,同时消耗x mol NH3,反应达平衡状态
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】常温下有H2RO4=H++HRO4-、HRO4-H++RO42-,现有物质的量浓度都为0.1molL-1的三种溶液:①NaHRO4溶液;②H2RO4溶液;③Na2RO4溶液。下列说法中正确的是( )
A.②和③等体积混合后的溶液中:c(Na+)=c(HRO4-)+c(H2RO4)+c(RO42-)
B.100mL①溶液中:n(HRO4-)+n(RO42-)+n(OH-) -n(H+)=0.01mol
C.①和②等体积混合后的溶液中离子浓度大小顺序为c(H+)>c(HRO4-)>c(Na+)
D.若①和③等体积混合后,会抑制水的电离,则HRO4-的电离程度肯定大于RO42-的水解程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是

A. 反应①为取代反应,有机产物与水混合浮在上层
B. 反应②为氧化反应,反应现象是火焰明亮并带有浓烟
C. 反应③为取代反应,有机产物是一种烃
D. 反应④中1 mol苯最多与3 mol H2发生加成反应,因为每个苯分子含有三个碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己烯是重要的化工原料。其实验室制备流程如下:

回答下列问题:
Ⅰ.环己烯的制备与提纯
(1)原料环己醇中若含苯酚杂质,检验试剂为____________,现象为__________________。
(2)操作1![]() 装置如图所示(加热和夹持装置已略去)。
装置如图所示(加热和夹持装置已略去)。

①烧瓶A中进行的可逆反应化学方程式为________________________
②仪器B的作用为____________。
(3)将操作3(蒸馏)的步骤补齐:安装蒸馏装置,加入待蒸馏的物质和沸石,____________,弃去前馏分,收集83℃的馏分。
Ⅱ.环己烯含量的测定
在一定条件下,向![]() 环己烯样品中加入定量制得的
环己烯样品中加入定量制得的![]() ,与环己烯充分反应后,剩余的
,与环己烯充分反应后,剩余的![]() 与足量
与足量![]() 作用生成
作用生成![]() ,生成的I2用
,生成的I2用![]() 的
的![]() 标准溶液与其反应,恰好消耗
标准溶液与其反应,恰好消耗![]() 标准溶液
标准溶液![]() (以上数据均已扣除干扰因素)。
(以上数据均已扣除干扰因素)。
测定过程中,发生的反应如下:①![]()
②![]() I2+2Na2S2O3=2NaI+Na2S4O6
I2+2Na2S2O3=2NaI+Na2S4O6
(4)计算样品中环己烯的质量分数为____________(用字母表示)。
(5)下列情况会导致测定结果偏低的是____________(填序号)。
a.样品中含有苯酚杂质 b.在测定过程中部分环己烯挥发 c.![]() 标准溶液部分被氧化
标准溶液部分被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是( )
A.铁和稀硫酸反应:2Fe + 6H+= 2Fe3+ +3H2↑
B.NaHCO3溶液与NaOH溶液反应: OH- + HCO![]() = H2O + CO
= H2O + CO![]()
C.钠和水反应: Na+2H2O = Na++2OH-+H2↑
D.Fe2+和Cl2的反应:Fe2++ Cl2 = Fe3++ 2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述不正确的是( )
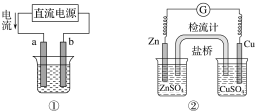
A.用图①装置实现铁上镀铜,a极为铜,电解质溶液可以是CuSO4溶液
B.图②装置盐桥中KCl的Cl-移向右烧杯
C.图③装置中钢闸门应与外接电源的负极相连获得保护
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中加入等物质的量的A、B,发生如下反应:2A(g)+2B(g) ![]() 3C(s)+4D(g),平衡常数随温度和压强的变化如表所示:
3C(s)+4D(g),平衡常数随温度和压强的变化如表所示:
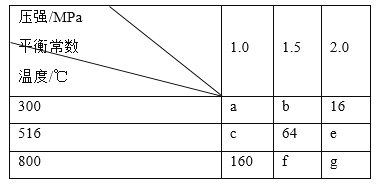
下列判断正确的是( )
A.g>f
B.ΔH<0
C.2.0MPa、800℃时,A的转化率最小
D.1.5MPa、300℃时,B的转化率为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写不正确的是( )
A.硫酸与Na2SiO3溶液混合:SiO![]() +2H+===H2SiO3↓
+2H+===H2SiO3↓
B.Cl2和NaOH溶液反应:Cl2+2OH-===Cl-+ClO-+H2O
C.向亚硫酸氢钠溶液中滴加硫酸氢钠溶液:H++HSO![]() ===SO2↑+H2O
===SO2↑+H2O
D.向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO![]() ===BaSO4↓
===BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组对卤素及其化合物的制备和性质进行如下探究实验,根据实验回答问题。
I.探究氯化亚铁与氧气反应的产物
已知氯化亚铁的熔点为674℃,沸点为1023℃;三氯化铁在100℃左右时升华,极易水解。在500℃条件下氯化亚铁与氧气可能发生下列反应:12FeCl2+3O2![]() 2Fe2O3+8FeCl3,4FeCl2+3O2
2Fe2O3+8FeCl3,4FeCl2+3O2![]() 2Fe2O3+4Cl2。该化学小组选用如图部分装置(装置可以重复选用)进行氯化亚铁与氧气反应产物的探究。
2Fe2O3+4Cl2。该化学小组选用如图部分装置(装置可以重复选用)进行氯化亚铁与氧气反应产物的探究。

(1)实验装置的合理连接顺序为:A→__________→D,装置E的作用是___________。
(2)D中发生反应的离子方程式_______。
(3)某化学兴趣小组在控制在500℃下发生反应,一段时间后的产物进行了如下实验探究:
①对B中反应剩余固体的成分开展实验探究,并作出以下两种假设:
假设一:产物为Fe2O3;
假设二:产物为________(填化学式)。
以下针对上述假设一,展开实验研究,请完善下面表格:
实验操作 | 预期现象与结论 |
取少量固体样品于一支洁净的试管中,加入足量的蒸馏水。 | ______,则假设一成立,否则,假设一不成立。 |
②对固体产物(标准状况下)成分含量进行了如下实验探究:B中反应剩余固体的质量经测定为m1g ,E中生成物的质量经测定为m2g。B中反应剩余固体按探究①的实验步骤进行操作,并最终得到干燥纯净的固体质量为m3g。则固体产物中Fe2O3所占的质量分数为______。
Ⅱ.卤素化合物之间反应实验条件控制探究
(4)室温下,KClO3可将KI氧化为I2或KIO3。下面是该小组设计的一组实验数据记录表:
试管编号 | 1 | 2 | 3 | 4 |
0.20 mol·L-1KI溶液/ mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0 mol·L-1H2SO4溶液/ mL | 0 | 3.0 | 6.0 | 9.0 |
蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
反应完全后,滴加2滴淀粉溶液 | 无色 | 蓝色 | 蓝色较2浅 | 无色 |
①根据实验数据,结合所学化学知识,下列说法正确的是______
A.该实验目的是探究其它条件相同时,酸的浓度对反应产物的影响
B.实验1和实验4说明硫酸浓度太低或太浓,KClO3与KI均不反应
C.实验2的现象说明在该硫酸浓度下KClO3将KI氧化为I2
D.实验3蓝色较2浅的原因是在该硫酸浓度下淀粉部分水解
②2号试管反应完全后,假设还原产物只有KC1,写出反应的离子方程式___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com