
【题目】用零价铁![]() 去除水体中的硝酸盐
去除水体中的硝酸盐![]() 已成为环境修复研究的热点之一.
已成为环境修复研究的热点之一.
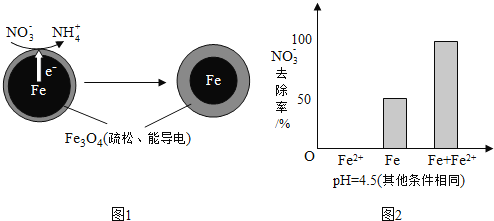
![]() 还原水体中
还原水体中![]() 的反应原理如图1所示.
的反应原理如图1所示.
①作负极的物质是______.
②正极的电极反应式是______.
![]() 将足量铁粉投入水体中,经24小时测定
将足量铁粉投入水体中,经24小时测定![]() 的去除率和pH,结果如下:
的去除率和pH,结果如下:
初始pH |
|
|
| 接近 |
|
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
![]() 时,
时,![]() 的去除率低.其原因是______.
的去除率低.其原因是______.
![]() 实验发现:在初始
实验发现:在初始![]() 的水体中投入足量铁粉的同时,补充一定量的
的水体中投入足量铁粉的同时,补充一定量的![]() 可以明显提高
可以明显提高![]() 的去除率.对
的去除率.对![]() 的作用提出两种假设:
的作用提出两种假设:
Ⅰ![]() 直接还原
直接还原![]() ;
;
Ⅱ![]() 破坏
破坏![]() 氧化层.
氧化层.
①做对比实验,结果如图2所示,可得到的结论是______.
②同位素示踪法证实![]() 能与
能与![]() 反应生成
反应生成![]() 结合该反应的离子方程式,解释加入
结合该反应的离子方程式,解释加入![]() 提高
提高![]() 去除率的原因:______.
去除率的原因:______.
![]() 其他条件与
其他条件与![]() 相同,经1小时测定
相同,经1小时测定![]() 的去除率和pH,结果如表:
的去除率和pH,结果如表:
初始pH |
|
|
| 约 | 约 |
1小时pH | 接近中性 | 接近中性 |
与![]() 中数据对比,解释
中数据对比,解释![]() 中初始pH不同时,
中初始pH不同时,![]() 去除率和铁的最终物质形态不同的原因:______.
去除率和铁的最终物质形态不同的原因:______.
【答案】铁 ![]()
![]() 不导电,阻碍电子转移 本实验条件下,
不导电,阻碍电子转移 本实验条件下,![]() 不能直接还原
不能直接还原![]() ;在Fe和
;在Fe和![]() 共同作用下能提高
共同作用下能提高![]() 的去除率
的去除率 ![]() ,
,![]() 将不导电的
将不导电的![]() 转化为可导电的
转化为可导电的![]() ,利于电子转移 初始pH低时,产生的
,利于电子转移 初始pH低时,产生的![]() 充足;初始pH高时,产生的
充足;初始pH高时,产生的![]() 不足
不足
【解析】
(1)NO3-在正极得电子发生还原反应产生NH4+,根据图2信息可知为酸性环境;(2)pH越高Fe3+越易水解生成FeO(OH);
(3)①根据图2中的三个实验结果进行分析;
②结合(2)题中的铁的最终物质形态结果差异进行分析;
(1) ①Fe还原水体中![]() ,则Fe作还原剂发生氧化反应,失去电子,作负极,
,则Fe作还原剂发生氧化反应,失去电子,作负极,
故答案为:铁;
![]() 在正极得电子发生还原反应产生
在正极得电子发生还原反应产生![]() ,根据图2信息可知为酸性环境,则正极的电极反应式为:
,根据图2信息可知为酸性环境,则正极的电极反应式为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)①加入![]() 可以显提高
可以显提高![]() 的去除率,pH越高,
的去除率,pH越高,![]() 越易水解生成
越易水解生成![]() ,而
,而![]() 不导电,阻碍电子转移,所以
不导电,阻碍电子转移,所以![]() 的去除率低,故答案为:
的去除率低,故答案为:![]() 不导电,阻碍电子转移;
不导电,阻碍电子转移;
(3)从图2的实验结果可以看出,单独加入![]() 时,
时,![]() 的去除率为0,因此得出
的去除率为0,因此得出![]() 不能直接还原
不能直接还原![]() ;而Fe和
;而Fe和![]() 共同加入时
共同加入时![]() 的去除率比单独Fe高,因此可以得出结论:本实验条件下,
的去除率比单独Fe高,因此可以得出结论:本实验条件下,![]() 不能直接还原
不能直接还原![]() ;在Fe和
;在Fe和![]() 共同作用下能提高
共同作用下能提高![]() 的去除率,故答案为:本实验条件下,
的去除率,故答案为:本实验条件下,![]() 不能直接还原
不能直接还原![]() ;在Fe和
;在Fe和![]() 共同作用下能提高
共同作用下能提高![]() 的去除率;
的去除率;
![]() 同位素示踪法证实了
同位素示踪法证实了![]() 能与
能与![]() 反应生成
反应生成![]() ,离子方程式为:
,离子方程式为:![]() ,
,![]() 将不导电的
将不导电的![]() 转化为可导电的
转化为可导电的![]() ,利于电子转移,故答案为:
,利于电子转移,故答案为:![]() ,
,![]() 将不导电的
将不导电的![]() 转化为可导电的
转化为可导电的![]() ,利于电子转移;
,利于电子转移;
(4)根据实验结果可知![]() 的作用是将不导电的
的作用是将不导电的![]() 转化为可导电的
转化为可导电的![]() ,而
,而![]() 的去除率由铁的最终物质形态确定,因此可知实验初始pH会影响
的去除率由铁的最终物质形态确定,因此可知实验初始pH会影响![]() 的含量,故答案为:初始pH低时,产生的
的含量,故答案为:初始pH低时,产生的![]() 充足;初始pH高时,产生的
充足;初始pH高时,产生的![]() 不足。
不足。


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入![]() 和
和![]() ,一定条件下使反应
,一定条件下使反应![]() 达到平衡,正反应速率随时间变化的示意图如图所示
达到平衡,正反应速率随时间变化的示意图如图所示![]() 由图得出的结论不正确的是
由图得出的结论不正确的是
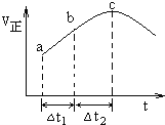
A. 反应过程中压强始终不变
B. 反应物浓度:a点大于b点
C. 反应物的总能量高于生成物的总能量
D. ![]() 时,
时,![]() 的转化率:
的转化率:![]() 段小于
段小于![]() 段
段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol I2(g)和2 mol H2置于某2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g) ![]() 2HI(g)ΔH<0,并达到平衡。HI的体积分数w(HI)随时间t变化如图曲线(Ⅰ)所示。
2HI(g)ΔH<0,并达到平衡。HI的体积分数w(HI)随时间t变化如图曲线(Ⅰ)所示。
(1)达到平衡时,I2(g)的物质的量浓度为______________mol·L-1。
(2)若改变反应条件,在甲条件下w(HI)的变化如图曲线(Ⅱ)所示,在乙条件下w(HI)的变化如图曲线(Ⅲ)所示。则甲条件可能是______________,乙条件可能是______________。(填入下列条件的序号)
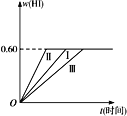
①恒容条件下,升高温度 ②恒容条件下,降低温度 ③恒温条件下,缩小反应容器体积 ④恒温条件下,扩大反应容器体积 ⑤恒温恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2L密闭容器中加入a mol I2(g),b mol H2(g)和c molHI(g)(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c的关系是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是一种重要有机物,其合成路线如下:
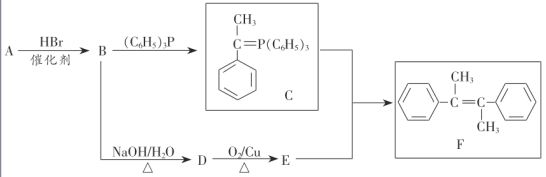
已知:①烃A的相对分子质量为104;
②E的核磁共振氢谱有4组吸收峰;
③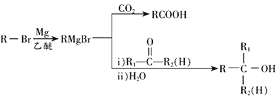
请回答以下问题:
⑴A的化学名称为________,E中官能团名称是________
⑵B→D的反应类型为________,F中共平面的碳原子最多有________个.
⑶D→E的化学方程式为________
⑷上述流程中可能得到一种与E互为同分异构体的副产物,该物质的结构简式为________
⑸D的一种同分异构体X,能与FeCl3溶液发生显色反应,则X共有________种.![]() 不含立体异构
不含立体异构![]()
⑹参照题干有关信息,设计一条由溴苯和乙醇为原料制备A的合成路线:________(其他无机试剂和溶剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2SO3的电离常数K1=1.3×10-2,K2=6.2×10-8,将amolL-1NaHSO3溶液与bmolL-1NaOH溶液等体积混合(a>0,b>0),混合所得溶液中微粒的物质的量浓度关系正确的是
A.a=b时:c(OH-)=c(H+)+c(HSO3-)
B.a=3b时:c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
C.当溶液pH=7时:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)=c(H+)
D.若4c(Na+)=5c(SO32-)+5c(HSO3-)+5c(H2SO3),则a=4b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有如下3个热化学方程式:H2(g)+![]() O2(g)= H2O(g) △H=a kJ/mol,H2(g)+
O2(g)= H2O(g) △H=a kJ/mol,H2(g)+ ![]() O2(g)= H2O(l) △H=b kJ/mol,2H2(g) +
O2(g)= H2O(l) △H=b kJ/mol,2H2(g) + ![]() O2(g)= 2H2O(l) △H=c kJ/mol,关于它们的下列表述正确的是:
O2(g)= 2H2O(l) △H=c kJ/mol,关于它们的下列表述正确的是:
A.它们都是吸热反应B.a、b、c均为正值C.a=bD.c=2b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香烃A是基本有机化工原料,由A制备高分子E和医药中间体K的合成路线(部分反应条件略去)如下图所示:
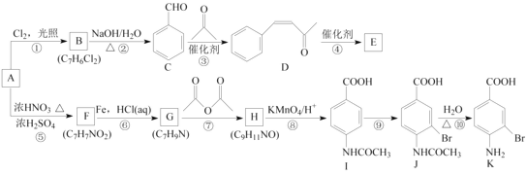
己知:①![]() ;
;
②
回答下列问题:
(1)A的名称是________,I含有官能团的名称是________。
(2)反应⑦的作用是________,⑩的反应类型是________。
(3)写出反应②的化学方程式:____________________________________________________。
(4)D分子中最多有________个原子共平面。E的结构简式为________。
(5)写出一种同时符合下列条件的F的同分异构体的结构简式:________。
①苯环上只有两种不同化学环境的氢原子;
②既能与银氨溶液反应又能与NaOH溶液反应。
(6)将由D为起始原料制备![]() 的合成路线补充完整。
的合成路线补充完整。
 ________(无机试剂及溶剂任选)。
________(无机试剂及溶剂任选)。
合成路线流程图示例如下:
CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类、油脂、蛋白质都是与生命息息相关的物质,下列有关说法正确的是![]()
![]()
A.葡萄糖和蔗糖是同系物,淀粉和纤维素是同分异构体
B.淀粉、纤维素、油脂、蛋白质都是高分子化合物,都能发生水解反应
C.“春蚕到死丝方尽,蜡炬成灰泪始干”中的“丝”“泪”分别是纤维素和油脂
D.通过灼烧时产生的气味可以鉴别蚕丝和棉纱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是
操作 | 可能的实验现象 | 解释 | |
A | 用硫酸做催化剂的淀粉水解液中,加入新制的Cu(OH)2悬浊液,加热 | 有红色沉淀生成 | 葡萄糖含醛基 |
B | 向酚酞溶液中加入足量Na2O2 | 溶液先变红后褪色 | Na2O2与水生成的碱有漂白性 |
C | 将已氧化的Cu丝从酒精灯的外焰慢慢移向内焰 | 黑色的Cu丝变红 | CuO被内焰中的乙醇蒸气还原 |
D | 向饱和Na2CO3溶液中通入CO2 | 有晶体析出 | 溶解度:Na2CO3>NaHCO3 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com