
(6分) 酸性KMnO4、H2O2、NaClO在生产、生活、卫生医疗中常用作消毒剂,其中H2O2还可用于漂白,是化学实验室里必备的重要氧化试剂。高锰酸钾造成的污渍可用还原性的草酸 (H2C2O4 )去除Fe(NO3)3也是重要氧化试剂,下面是对这三种氧化剂性质的探究。
(1)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,写出该反应的化学方程式并用双线桥法在化学方程式上标出电子转移的方向和总数____________________。
(2)取300 mL 0.2 mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是________mol。
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色。写出溶液先变为浅绿色的离子方程式_________________________________。

(2)0.032 (3)2Fe3++SO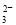 +H2O=2Fe2++SO
+H2O=2Fe2++SO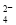 +2H+
+2H+
【解析】
试题分析:(1)过氧化氢与Cu在酸性条件下发生氧化还原反应,生成氯化铜和水,其中过氧化氢作氧化剂,得到2个电子,Cu作还原剂,失去2个电子,用双线桥表示为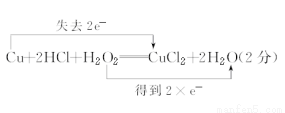 ;
;
(2)300 mL 0.2 mol/L的KI溶液中碘元素的物质的量是0.06mol,与高锰酸钾反应后生成等物质的量的碘和碘酸钾,所以单质碘的物质的量是0.02mol,碘酸钾中碘元素的化合价是+5价,则KI共失去电子的物质的量是0.02mol×2+0.02mol×6=0.16mol,而高锰酸钾被还原为+2价的锰离子,根据得失电子守恒,消耗高锰酸钾的物质的量是0.16mol/5=0.032mol;
(3)Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,说明铁离子与亚硫酸根离子发生氧化还原反应,生成亚铁离子的缘故,离子方程式为2Fe3++SO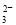 +H2O=2Fe2++SO
+H2O=2Fe2++SO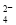 +2H+
+2H+
考点:考查氧化还原反应的分析与计算,双线桥的表示,离子方程式的书写


科目:高中化学 来源:2014-2015学年湖南邵阳县石齐学校高二上第一次月考化学(理)试卷(解析版) 题型:选择题
对于可逆反应:2A(g)+B(g)  2C(g) △H<0,下列图象正确的是( )
2C(g) △H<0,下列图象正确的是( )

查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高三上学期第二次月考化学试卷(解析版) 题型:实验题
(14分)硫代硫酸钠(Na2S2O3)是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
Ⅰ.【查阅资料】
(1)硫代硫酸钠(Na2S2O3)易溶于水,在中性或碱性环境中稳定,受热、遇酸易分解。
(2)Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
(3)向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3(反应方程式为:2Na2S+Na2CO3+ 4SO2===3Na2S2O3+CO2),所得产品常含有少量Na2SO3和Na2SO4。
Ⅱ.【制备产品】实验装置如图所示:

请回答下列问题:
(1)实验步骤:检查装置气密性后,向三颈瓶c中加入Na2CO3和Na2S的混合溶液,再将分液漏斗a中液体滴加到烧瓶b中加热发生反应产生SO2,请写出b中发生反应的化学方程式______________________。待Na2S和Na2CO3完全消耗后,结束反应。过滤c中的混合物,滤液经____________________(填写操作名称)、过滤、洗涤、干燥、得到产品。
(2) 装置A用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。
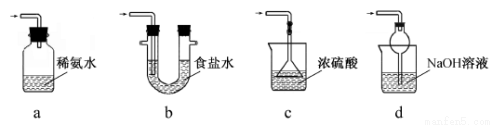
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是____________________。
III.【测定产品纯度】
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。
反应原理为2S2O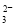 +I2===S4O
+I2===S4O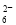 +2I-(忽略Na2SO3与I2反应)
+2I-(忽略Na2SO3与I2反应)
(4)滴定至终点时,溶液颜色的变化:_________________________________。
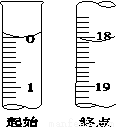
(5)滴定起始和终点的液面位置如图,则产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________。
IV.【探究与反思】
(6)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀盐酸、蒸馏水中选择)
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,_______________________________,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。.
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列反应中,反应后固体物质增重的是( )
A.氨气通过灼热的CuO粉末 B. 将锌粒投入Cu(NO3)2溶液
C.铝与Fe2O3发生铝热反应 D.水蒸气通过Na2O2粉末
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是( )
组别 | 甲 | 乙 | 丙 |
A | Al(OH)3 | HCl | NaOH |
B | NH3 | O2 | HNO3 |
C | SO2 | Ca(OH)2 | NaHCO3 |
D | O2 | N2 | H2 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高三上学期第一次月考化学试卷(解析版) 题型:选择题
在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为ρg·cm-3,溶质的质量分数为ω,溶质的物质的量浓度为c mol/L。下列叙述中正确的是
① ω=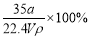 ② c=
② c=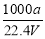
③ 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
④ 上述溶液中再加入1.5VmL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
A.①④B.②③C.①③D.②④
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高三上学期第一次月考化学试卷(解析版) 题型:选择题
化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。下列实验中所选用的仪器合理的是
①用50 mL量筒量取5.2 mL稀硫酸 ②用分液漏斗分离苯和四氯化碳的混合物 ③用托盘天平称量11.7g氯化钠晶体 ④用碱式滴定管取23.10 mL溴水 ⑤用瓷坩埚灼烧各种钠化合物 ⑥用250 mL容量瓶配制250 mL 0.2 mol/L的NaOH溶液
A.①②④ B.③⑥ C.②③④⑥ D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省浏阳市高一上第一次月考试卷化学试卷(解析版) 题型:填空题
(6分)某100 mL物质的量浓度为1 mol/L的NaOH溶液。试计算:
(1) 该溶液中NaOH的质量。
(2) 上述溶液与物质的量浓度为1 mol/L 的HCl溶液恰好完全反应,需HCl溶液的体积是多少毫升?
(3) 该反应后得到溶液中溶质的物质的量是 mol。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高一上学期期中化学试卷(解析版) 题型:选择题
人体血红蛋白中含有Fe2+,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+转变为Fe3+,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有
A、氧化性 B、碱性 C、酸性 D、还原性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com