
| A、0.2mol/L |
| B、0.3mol/L |
| C、0.4mol/L |
| D、0.35mol/L |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
A、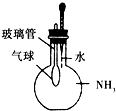 根据气球的变化证明氨气极易溶于水 |
B、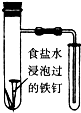 根据小试管中液面的变化判断铁钉发生析氢腐蚀 |
C、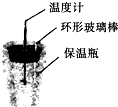 根据温度计读数的变化用稀盐酸和NaOH反应测定中和热 |
D、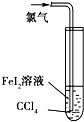 根据试管中液体颜色的变化比较Cl2、Fe3+、I2的氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol 蔗糖可水解生成2 mol葡萄糖 |
| B、CH3-CH=CH-CH3与C3H6一定互为同系物 |
| C、C4H9Cl共有同分异构体9种 |
D、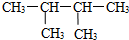 的名称是2,3-二甲基丁烷 的名称是2,3-二甲基丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、改进汽车尾气净化技术,减少大气污染物的排放 |
| B、过度开采矿物资源,促进地方经济发展 |
| C、开发利用新能源,减少化石燃料的使用 |
| D、加强对工业“三废”的治理,保护环境 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用湿润的碘化钾淀粉试纸检验氯化氢气体中是否混有氯气 |
| B、次氯酸具有酸性,可与碳酸钠反应产生二氧化碳气体 |
| C、新制氯水的酸性一定比久置的氯水强 |
| D、干燥氯气能使有色布条褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| J | ||
| R |
| A、J和氢组成的气态氢化物分子中只含有极性共价键 |
| B、M单质能与氢氧化钠溶液反应,产生一种可燃性气体 |
| C、R、T两元素的气态氢化物中,T的气态氢化物更稳定 |
| D、J、M、R、T元素最高价氧化物对应的水化物中酸性最强的是HTO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com