
| 催化剂 |
| Cu或Ag |
| △ |
| Cu或Ag |
| △ |
 CH3COOCH2CH3+H2O;化学反应温度高,反应快,酯化反应是可逆过程,乙酸与乙醇反应,浓硫酸吸水有利于平衡向生成乙酸乙酯方向移动,催化剂浓硫酸,能加快反应速率,常用饱和碳酸钠溶液,中和挥发出来的乙酸,使之转化为乙酸钠溶于水中;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯,碳酸钠溶液和足量乙酸反应的方程式为:Na2CO3+2CH3COOH═2CH3COONa+H2O+CO2↑,
CH3COOCH2CH3+H2O;化学反应温度高,反应快,酯化反应是可逆过程,乙酸与乙醇反应,浓硫酸吸水有利于平衡向生成乙酸乙酯方向移动,催化剂浓硫酸,能加快反应速率,常用饱和碳酸钠溶液,中和挥发出来的乙酸,使之转化为乙酸钠溶于水中;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯,碳酸钠溶液和足量乙酸反应的方程式为:Na2CO3+2CH3COOH═2CH3COONa+H2O+CO2↑, CH3COOCH2CH3+H2O;加热、使用催化剂浓硫酸;Na2CO3+2CH3COOH═2CH3COONa+H2O+CO2↑;
CH3COOCH2CH3+H2O;加热、使用催化剂浓硫酸;Na2CO3+2CH3COOH═2CH3COONa+H2O+CO2↑;


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、世界上第一个由人工合成的、具有生理活性的蛋白质--结晶牛胰岛素 |
| B、世界上首次人工合成的酵母丙氨酸转移核糖核酸 |
| C、发现元素周期律 |
| D、黑火药和造纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
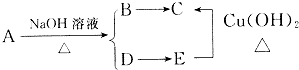
查看答案和解析>>
科目:高中化学 来源: 题型:
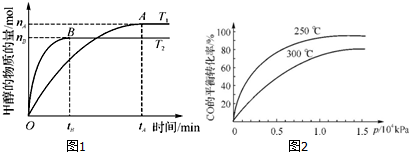
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3-CH=CH2 |
| B、CH3-CH=CH-CH=CH2 |
| C、CH3-CH=CH-CH2-CH3 |
| D、CH2=CH2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com