

| A. | 在此循环中发生了反应:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ | |
| B. | 燃料电池是将化学能转化为电能的装置 | |
| C. | 该氢能源的循环体系能够实现太阳能转化为电能 | |
| D. | 目前化学家急需解决的问题是寻找合适的光照条件下分解水的催化剂 |
分析 氢能源具有来源广、放热多、燃烧产物为水无污染的优点.该循环体系中水通过光分解催化剂和光照的条件分解成氢气和氧气,氢气和氧气发生化学反应又生成水同时转化成电能.现在氢能源作为人类理想中的能源大量使用还需解决合适的光照条件下分解水的催化剂、运输和储存问题.
解答 解:A.该循环体系中水生成氢气和氧气的过程中反应条件为光分解催化剂和光照,不是通电分解,故A错误;
B.化学电池是将化学能转化成电能的装置,故B正确;
C.该循环体系中,太阳能变成化学能,化学能又变成电能,故C正确;
D.现在氢能源作为人类理想中的能源大量使用还需解决合适的光照条件下分解水的催化剂、运输和储存问题,故D正确.
故选A.
点评 本题考查常见的能量转化形式,题目难度不大,社会的发展需要充足的能源,化石燃料的日渐枯竭使人们迫切要求开发新能源.氢能源具有来源广、放热多、燃烧产物为水无污染的优点.现在氢能源作为人类理想中的能源大量使用还需解决合适的光照条件下分解水的催化剂、运输和储存问题.


科目:高中化学 来源: 题型:解答题
 Fe3++3OH-.
Fe3++3OH-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)按已知的原子结构规律,27号元素在周期表中的位置是第四周期第Ⅷ族,其价电子的轨道排布图为
(1)按已知的原子结构规律,27号元素在周期表中的位置是第四周期第Ⅷ族,其价电子的轨道排布图为 .
. ),则配合物[Pt(en)2]Cl4中心离子的配位原子数为4.
),则配合物[Pt(en)2]Cl4中心离子的配位原子数为4. sp2
sp2 sp3
sp3

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{6(1-x)}{7}$ | B. | $\frac{1-x}{7}$ | C. | $\frac{3x}{4}$ | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c元素的非金属性最强 | |
| B. | 它们均存在两种或两种以上的氧化物 | |
| C. | 只有d与其他元素生成的化合物都是离子化合物 | |
| D. | a、b、c与氢形成的化合物中化学键均为极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
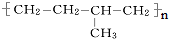 的单体的分子式为CH2=CH2 和CH2=CH-CH3
的单体的分子式为CH2=CH2 和CH2=CH-CH3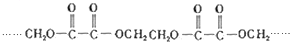 的单体的名称为HOOC-HOOC 和HOCH2-CH2OH.
的单体的名称为HOOC-HOOC 和HOCH2-CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com