
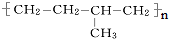 的单体的分子式为CH2=CH2 和CH2=CH-CH3
的单体的分子式为CH2=CH2 和CH2=CH-CH3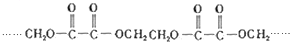 的单体的名称为HOOC-HOOC 和HOCH2-CH2OH.
的单体的名称为HOOC-HOOC 和HOCH2-CH2OH. 分析 (1)设烷烃的分子式为CxH(2x+2),根据相对分子质量为72,列出方程式进行计算x值,支链越多,沸点越低;
(2)葡萄糖是多羟基醛,谷氨酸是氨基酸;
(3)凡链节中主碳链为4个碳原子,无碳碳双键结构,其单体必为两种;
(4)连接主链中含有酯基,为酯化反应进行的缩聚反应生成高聚物,据此判断其单体.
解答 解:(1)设烷烃的分子式为CxH(2x+2),
则14x+2=72,解得x=5,
所以该烷烃的分子式为C5H12,
分子式为C5H12的同分异构体有主链有5个碳原子的:CH3CH2CH2CH2CH3,
主链有4个碳原子的:CH3CH(CH3)CH2CH3,
主链有3个碳原子的:CH3C(CH3)2CH3;
支链越多,沸点越低,故C(CH3)4,故答案为:C(CH3)4;
(2)葡萄糖的结构简式为CH2OH-CHOH-CHOH-CHOH-CHOH-CHO;谷氨酸的结构简式HOOC-CH2-CH2-CH(NH2)-COOH,故答案为:CH2OH(CHOH)4CHO;HOOC-CH2-CH2-CH(NH2)-COOH;
(3)凡链节中主碳链为4个碳原子,无碳碳双键结构,其单体必为两种,从主链中间断开后,再分别将两个半键闭合即得单体;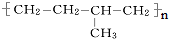 的单体为CH2=CH2 和CH2=CH-CH3,故答案为:CH2=CH2 和CH2=CH-CH3;
的单体为CH2=CH2 和CH2=CH-CH3,故答案为:CH2=CH2 和CH2=CH-CH3;
(4)由高聚物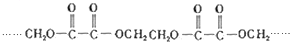 可知,连接主链中含有酯基,为酯化反应进行的缩聚反应生成高聚物,故该单体的结构简式为:HOOC-HOOC 和HOCH2-CH2OH,故答案为:HOOC-HOOC 和HOCH2-CH2OH.
可知,连接主链中含有酯基,为酯化反应进行的缩聚反应生成高聚物,故该单体的结构简式为:HOOC-HOOC 和HOCH2-CH2OH,故答案为:HOOC-HOOC 和HOCH2-CH2OH.
点评 本题考查命名方法的应用、有机物结构简式的书写、高聚物的单体的判断方法,要求学生具有分析和解决问题的能力,难度较大.


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在此循环中发生了反应:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ | |
| B. | 燃料电池是将化学能转化为电能的装置 | |
| C. | 该氢能源的循环体系能够实现太阳能转化为电能 | |
| D. | 目前化学家急需解决的问题是寻找合适的光照条件下分解水的催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数的变化如图所示.已知W的一种核素的质量数为18,中子数为10;X是短周期元素中原子半径最大的;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数的变化如图所示.已知W的一种核素的质量数为18,中子数为10;X是短周期元素中原子半径最大的;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是( )| A. | 简单离子半径:W>X>Z | |
| B. | 最简单气态氢化物的稳定性:Y<Z | |
| C. | 化合物XZW中既含离子键又含共价键 | |
| D. | Y的氧化物能与X的最高价氧化物对应的水化物反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
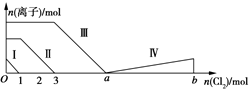 向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b-a=5线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素.下列说法正确的是( )
向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b-a=5线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素.下列说法正确的是( )| A. | 线段Ⅱ表示Br-的变化情况 | B. | 原溶液中n(FeI2):n(FeBr2)=3:1 | ||
| C. | 根据图象无法计算a的值 | D. | 线段Ⅳ表示IO${\;}_{3}^{-}$的变化情况 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏实验中温度计的水银球应插入液态混合物中 | |
| B. | 用酒精萃取碘水中的碘 | |
| C. | 分液时,打开旋塞,使下层液体从下口流出,上层液体从上口倒出 | |
| D. | 开始蒸馏时,应该先加热,再开冷凝水;蒸馏完毕,应先关冷凝水再撤酒精灯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有较高能量的反应物分子称为活化分子 | |
| B. | 升高温度增大了活化分子百分数 | |
| C. | 化剂能够改变化学反应途径 | |
| D. | 增大压强能提高活化分子的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50 mL 12 mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| B. | 2 L 0.5 mol•L-1亚硫酸溶液中含有的H+离子数为2NA | |
| C. | 过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com