
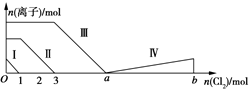
 向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b-a=5线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素.下列说法正确的是( )
向含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b-a=5线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素.下列说法正确的是( )| A. | 线段Ⅱ表示Br-的变化情况 | B. | 原溶液中n(FeI2):n(FeBr2)=3:1 | ||
| C. | 根据图象无法计算a的值 | D. | 线段Ⅳ表示IO${\;}_{3}^{-}$的变化情况 |
分析 向仅含Fe2+、I-、Br-的溶液中通入适量氯气,还原性I->Fe2+>Br-,首先发生反应:2I-+Cl2=I2+2Cl-,I-反应完毕,再反应反应:2Fe2++Cl2=2Fe3++2Cl-,Fe2+反应完毕,又发生反应2Br-+Cl2=Br2+2Cl-,故线段I代表I-的变化情况,线段Ⅱ代表Fe2+的变化情况,线段Ⅲ代表Br-的变化情况;
由通入氯气可知,根据反应离子方程式可知溶液中n(I-)=2n(Cl2)=2mol,溶液中n(Fe2+)=2n(Cl2)=2×(3mol-1mol)=4mol,Fe2+反应完毕,根据电荷守恒可知n(I-)+n(Br-)=2n(Fe2+),故n(Br-)=2n(Fe2+)-n(I-)=2×4mol-2mol=6mol,根据溴离子判断溶液中n(FeBr2),根据离子方程式计算溴离子反应需要的氯气的物质的量,据此计算a的值;
线段IV表示一种含氧酸,且I和IV表示的物质中含有相同的元素,该含氧酸中含有I元素,根据电子守恒计算出含氧酸中I的化合价,然后写出其化学式.
解答 解:向仅含Fe2+、I-、Br-的溶液中通入适量氯气,还原性I->Fe2+>Br-,首先发生反应2I-+Cl2=I2+2Cl-,I-反应完毕,再反应反应2Fe2++Cl2=2Fe3++2Cl-,Fe2+反应完毕,最后发生反应2Br-+Cl2=Br2+2Cl-,故线段I代表I-的变化情况,线段Ⅱ代表Fe2+的变化情况,线段Ⅲ代表Br-的变化情况;
由通入氯气可知,根据反应离子方程式可知溶液中n(I-)=2n(Cl2)=2mol,溶液中n(Fe2+)=2n(Cl2)=2×(3mol-1mol)=4mol,Fe2+反应完毕,根据电荷守恒可知n(I-)+n(Br-)=2n(Fe2+),故n(Br-)=2n(Fe2+)-n(I-)=2×4mol-2mol=6mol,
A.根据分析可知,线段Ⅱ为亚铁离子被氯气氧化为铁离子,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,不是氧化溴离子,故A错误;
B.n(FeI2):n(FeBr2)=n(I-):n(Br-)=2mol:6mol=1:3,故B错误;
C.由分析可知,溶液中n(Br-)=2n(Fe2+)-n(I-)=2×4mol-2mol=6mol,根据2Br-+Cl2=Br2+2Cl-可知,溴离子反应需要氯气的物质的量为3mol,故a=3+3=6,故C错误;
D.线段IV表示一种含氧酸,且I和IV表示的物质中含有相同的元素,该元素为I元素,已知碘单质的物质的量为2mol,反应消耗氯气的物质的量为5mol,根据电子守恒,则该含氧酸中碘元素的化合价为:$\frac{(1-0)×2×5mol}{2mol}$=+5价,则该含氧酸为HIO3,即:线段Ⅳ表示IO3-的变化情况,故D正确;
故选D.
点评 本题考查氧化还原反应计算、氧化还原反应先后顺序、氧化性和还原性强弱比较等知识,试题综合性较强,难度较大,明确反应过程及反应原理为解题关键,试题培养了学生的分析能力及逻辑推理能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol X、3mol Y | 2mol Z | 4mol Z |
| Z的浓度 (mol•L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | α1 | α2 | α3 |
| A. | 2c1>c3 | B. | a+b=Q | C. | 2p2<p3 | D. | α1+α3>1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 我国科学家成功研发了甲烷和二氧化碳的共转化技术,利用分子筛催化剂高效制得乙酸,下列有关说法正确的是( )
我国科学家成功研发了甲烷和二氧化碳的共转化技术,利用分子筛催化剂高效制得乙酸,下列有关说法正确的是( )| A. | 消耗22.4 LCO2可制得1mol乙酸 | |
| B. | 该反应属于取代反应 | |
| C. | 反应物和生成物中均含有极性键和非极性键 | |
| D. | 该反应过程符合“绿色化学”原理,其原子利用率为100% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
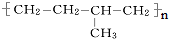 的单体的分子式为CH2=CH2 和CH2=CH-CH3
的单体的分子式为CH2=CH2 和CH2=CH-CH3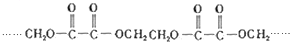 的单体的名称为HOOC-HOOC 和HOCH2-CH2OH.
的单体的名称为HOOC-HOOC 和HOCH2-CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 氧化物 | CaO | Al2O3 | SiO2 | H2O |
| 质量分数 | 0.1420 | 0.2602 | 0.4592 | 0.1378 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 $\stackrel{△}{→}$
$\stackrel{△}{→}$
 .
. +(2n-1)H2O.
+(2n-1)H2O. (写出其中一种结构简式).
(写出其中一种结构简式). )的合成路线示意图(不能超过5步).
)的合成路线示意图(不能超过5步). →
→ +H2O
+H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com