
【题目】向仅含SO![]() 、I-、Br-且物质的量分别为m、n、6 mol 的钠盐溶液中通入适量氯气,溶液中这三种离子的物质的量的变化如图所示。下列说法中正确的是( )
、I-、Br-且物质的量分别为m、n、6 mol 的钠盐溶液中通入适量氯气,溶液中这三种离子的物质的量的变化如图所示。下列说法中正确的是( )
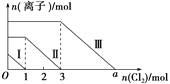
A. 曲线Ⅱ代表Br-的变化情况
B. 曲线Ⅰ对应的反应:SO![]() +Cl2+H2O===2H++SO
+Cl2+H2O===2H++SO![]() +2Cl-
+2Cl-
C. 通入的氯气为5 mol时,溶液中的主要阴离子为Cl-、SO![]()
D. 溶液中n(Na+)=n(SO![]() )+n(I-)+n(Br-)
)+n(I-)+n(Br-)
【答案】B
【解析】
向仅含SO32-、I-、Br-的溶液中通入适量氯气,根据还原性:SO32->I->Br-,首先发生反应:SO![]() +Cl2+H2O===2H++SO
+Cl2+H2O===2H++SO![]() +2Cl-,SO
+2Cl-,SO![]() 反应完毕,再发生反应:2I-+Cl2═I2+2Cl-,I-反应完毕,最后发生反应:2Br-+Cl2═Br2+2Cl-,故线段Ⅰ代表SO
反应完毕,再发生反应:2I-+Cl2═I2+2Cl-,I-反应完毕,最后发生反应:2Br-+Cl2═Br2+2Cl-,故线段Ⅰ代表SO![]() 的变化情况,线段Ⅱ代表I-的变化情况,线段Ⅲ代表Br-的变化情况;
的变化情况,线段Ⅱ代表I-的变化情况,线段Ⅲ代表Br-的变化情况;
由通入氯气可知,根据反应离子方程式可知溶液中SO![]() +Cl2+H2O===2H++SO
+Cl2+H2O===2H++SO![]() +2Cl-,n(SO
+2Cl-,n(SO![]() )=n(Cl2)=1mol,n(I-)=2n(Cl2)=4mol,溶液中n(Br-)=2n(Cl2)=2×3mol=6mol。
)=n(Cl2)=1mol,n(I-)=2n(Cl2)=4mol,溶液中n(Br-)=2n(Cl2)=2×3mol=6mol。
A、SO![]() 、I-、Br-的还原性顺序为SO
、I-、Br-的还原性顺序为SO![]() >I->Br-,曲线Ⅰ代表Cl2将SO
>I->Br-,曲线Ⅰ代表Cl2将SO![]() 氧化为SO
氧化为SO![]() 的变化情况,曲线Ⅱ代表I-的变化情况,曲线Ⅲ代表Br-的变化情况,故A错误;
的变化情况,曲线Ⅱ代表I-的变化情况,曲线Ⅲ代表Br-的变化情况,故A错误;
B、曲线Ⅰ代表Cl2将SO![]() 氧化为SO
氧化为SO![]() 的变化情况,曲线Ⅰ对应的反应:SO
的变化情况,曲线Ⅰ对应的反应:SO![]() +Cl2+H2O===2H++SO
+Cl2+H2O===2H++SO![]() +2Cl-,故B正确;
+2Cl-,故B正确;
C、氯气与SO![]() 先反应,由得失电子守恒原理可求出m=1 mol,由2I-+Cl2===2Cl-+I2可求出n=3 mol,由2Br-+Cl2===Br2+2Cl-,知6 mol Br-消耗Cl2 3 mol,则a=3+3=6,故当通入的氯气为5 mol时,SO
先反应,由得失电子守恒原理可求出m=1 mol,由2I-+Cl2===2Cl-+I2可求出n=3 mol,由2Br-+Cl2===Br2+2Cl-,知6 mol Br-消耗Cl2 3 mol,则a=3+3=6,故当通入的氯气为5 mol时,SO![]() 、I-已被氧化为SO
、I-已被氧化为SO![]() 和I2,Br-还有一部分没有被氧化,C项错误;
和I2,Br-还有一部分没有被氧化,C项错误;
D、由电荷守恒知溶液中n(Na+)=2n(SO![]() )+n(I-)+n(Br-),故D错误。
)+n(I-)+n(Br-),故D错误。
故选B。


 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:
【题目】有反应4HCl(g)+O2(g)═2Cl2(g)+2H2O(g),已知2 mol O2被还原时,放出a kJ的热量,且知断开1 mol O=O键需要吸收b kJ的热量,断开1 mol Cl—Cl键需要吸收c kJ的热量。则断开1 mol H—O键比断开1 mol H—Cl键所需能量高
A. (b-a-2c)/4kJB. (a+2b-4c)/8kJC. (a+b-2c)/4kJD. (2b-a-4c)/8kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4溶液是中学化学及工农业生产中常见的一种试剂。
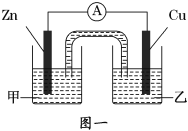
(1)某同学配制CuSO4溶液时,向盛有一定量硫酸铜晶体的烧杯中加入适量的蒸馏水,并不断搅拌,结果得到悬浊液。他认为是固体没有完全溶解,于是对悬浊液加热,结果发现浑浊更明显了。原因是(用离子方程式和简要文字说明表示)___________________________,最后,他向烧杯中加入了一定量的_________________溶液,得到了澄清的CuSO4溶液。
(2)该同学利用制得的CuSO4溶液,进行了以下实验探究。
①图一是根据反应Zn+CuSO4═Cu+ZnSO4设计成的锌铜原电池。电解质溶液乙是______溶液,Cu极的电极反应式是____________________。
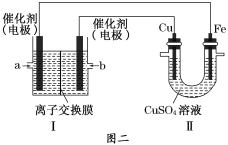
②图二中,Ⅰ是甲烷燃料电池(电解质溶液为NaOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则Fe电极为__________(填“阳极”或“阴极”)。若铜电极的质量减轻3.2 g,则消耗的CH4在标准状况下的体积为___________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,自来水的消毒、农药的生产、药物的合成等都需要用氯气.
I.工业上通常采用电解法制氯气:观察下图,回答:
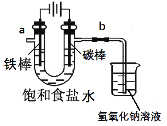
(1)电解反应的化学方程式为____________________。
(2)饱和食盐水通电后,b端产生的气体检验方法是____________。
II. 实验室用NaOH固体配制100 mL 1.0 mol·L-1的NaOH溶液,试回答下列各题:
(3)需要用托盘天平称量_______g NaOH固体;
(4)实验室有下列仪器:①漏斗 ②200mL容量瓶 ③烧杯 ④玻璃棒 ⑤药匙 ⑥托盘天平 ⑦冷凝。若要实施溶液配制,尚缺的玻璃仪器是___________、________;
(5)容量瓶在使用前必须先____________;
(6)配制过程有以下操作: ①称量 ②移液 ③冷却 ④洗涤 ⑤定容 ⑥溶解 ⑦摇匀 其正确的操作顺序应是:① →_________→________ →________ →________→________→ ⑦
(7)下列五项操作中会导致所得溶液浓度偏低的有____________(填序号);
①没有洗涤烧杯内壁和玻璃棒
②未冷却到室温就将溶液转移到容量瓶并定容
③在转移过程中有溶液撒在外面
④定容时观察液面时俯视
⑤定容后,把容量瓶反复摇匀后发现液面低于刻度线,便滴加几滴水至刻度处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. 向NaOH溶液中通入过量CO2:2OH-+CO2===![]() +H2O
+H2O
B. 电解氯化镁溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C. 向H2O2溶液中滴加MnO2:2H2O2+4H++MnO2===O2↑+Mn2++4H2O
D. 向KAl(SO4)2溶液中滴加Ba(OH)2溶液至![]() 沉淀完全:Al3++2
沉淀完全:Al3++2![]() +2Ba2++4OH-===
+2Ba2++4OH-===![]() +2BaSO4↓+2H2O
+2BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F六种物质,它们的相互转化关系如下图(反应条件略,有些反应的产物和反应的条件没有全部标出)。已知A、B、E是单质,其中A着火只能用干燥的沙土灭火,B在常温下为气体,C俗名称为烧碱,D为无色无味液体。

(1)写出A、B、F的化学式 A______ B ______ F ______。
(2)写出A和D反应生成B和C的化学方程式_____________。若生成3mol的B,则转移的电子数目为_______________ 。
(3)写出E与C、D反应生成的B和F离子方程式____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写不正确的是
A.向CaCl2 溶液中通入少量CO2气体:Ca2+ + CO2 + H2O=CaCO3↓ + 2H+
B.大理石与醋酸反应:CaCO3 + 2CH3COOH= Ca2+ + 2CH3COO-+ H2O + CO2↑
C.制备Fe(OH)3胶体:Fe3+ + 3H2O![]() Fe(OH)3(胶体)+ 3H+
Fe(OH)3(胶体)+ 3H+
D.少量碳酸氢钠溶液与足量石灰水反应:Ca2+ + OH-+ HCO3-=CaCO3↓ + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质中:①SO2 ②液态氯化氢 ③CH4 ④熔融NaOH ⑤NH4Cl固体 ⑥氨水。能导电的是__________(填序号,下同)。属于电解质的是__________。属于非电解质的是__________。
(2)1.204×1024个H2SO4分子的物质的量为__________mol,共含__________个氢原子。将上述H2SO4溶于水配成600 mL溶液,再加水稀释到1000 mL,稀释后溶液的物质的量浓度为__________mol/L。
(3)K2SO4和Fe2(SO4)3的混合溶液,已知其中Fe3+的浓度为0.5mol/L,SO42-浓度为0.9mol/L,则K+的物质的量浓度为__________mol/L。
(4)有以下四种物质:① 标准状况下11.2 L CO2 ② 5 g H2 ③ 1.204×1024个N2分子 ④ 18 g H2O,其中质量最大的是____(填序号),在常温常压下体积最大的是___(填序号)。
(5)标准状况下11.2 L由CH4、N2组成的混和气体的质量为10 g,该混合气体中CH4与N2的分子数之比为_________。
(6)将标准状况下336 L HCl气体完全溶于1 L水中,所得溶液的密度为 ρ g/cm3,则该溶液的物质的量浓度为_____ mol/L(计算结果中的数字保留整数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柠檬烯(结构如图1所示)是食品行业中常用的一种香精,柠檬烯熔点为-74.3℃,沸点为177℃,难溶于水,在接近100℃时有一定的挥发性。柠檬、橙子和柚子等水果果皮中存在较多的柠檬烯,实验室通常用水蒸气蒸馏(装置如图2所示)的方法将柠檬烯从果皮中提取出来并进行后续的分离提纯。
水蒸气蒸馏:将60g橙子皮剪成碎片投入仪器B中,加入30mL蒸馏水,打开T形管活塞,点燃酒精灯加热水蒸气发生装置,待T形管支管口有大量水蒸气冒出时关闭活塞并开始通入冷凝水,当D中收集到约60~70mL馏出液时停止蒸馏。
分离提纯:将馏出液倒入分液漏斗,每次用10mL二氯甲烷(沸点39.95℃)萃取三次,萃取液合并后置于锥形瓶中,加入适量无水硫酸镁,半小时后过滤,将滤液进行蒸馏除去二氯甲烷,蒸馏烧瓶中得到主要成分是柠檬烯的橙油。
请回答相关问题。

(1)仪器A的名称是____。安全管下端不能抵住仪器A的底部,原因是__。仪器B中水蒸气导入管管口接近瓶底,目的是___。
(2)直形冷凝管填能否更换为球形冷凝管___(“能”或“否”),原因是___。
(3)分离提纯过程中加入无水硫酸镁的作用是____。对滤液进行蒸馏时合适的加热方法是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com