
【题目】下列指定反应的离子方程式正确的是( )
A. 向NaOH溶液中通入过量CO2:2OH-+CO2===![]() +H2O
+H2O
B. 电解氯化镁溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C. 向H2O2溶液中滴加MnO2:2H2O2+4H++MnO2===O2↑+Mn2++4H2O
D. 向KAl(SO4)2溶液中滴加Ba(OH)2溶液至![]() 沉淀完全:Al3++2
沉淀完全:Al3++2![]() +2Ba2++4OH-===
+2Ba2++4OH-===![]() +2BaSO4↓+2H2O
+2BaSO4↓+2H2O
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某学生欲配制3.6 mol/L的H2SO4溶液80 mL,探究硫酸的性质。实验室有两种不同浓度的硫酸可供选用:① 25%的硫酸(ρ=1.18 g/mL);②98%的硫酸 (ρ=1.8 g/mL)。请回答下列问题:
(1)配制该硫酸溶液应选用的玻璃仪器除量筒、烧杯和玻璃棒外还有________;
(2)本实验需量取所选用硫酸的体积为____________________mL;
(3)下列操作会使得所配硫酸溶液浓度偏低的是____________
a.量取硫酸溶液的量筒未用蒸馏水洗涤
b.硫酸稀释后立即转移至容量瓶中
c.转移的时候不小心有少许洒到实验台上
d.定容摇匀时,液面下降又加水
e.定容时仰视刻度线
(4)取所配硫酸溶液,往其中加入BaCl2溶液,观察有白色沉淀出现。试回答:如何证明溶液中的硫酸根离子沉淀完全?__________________________________;
(5)将100mL标号为②的浓硫酸与水(密度为1g/ml)混合,其质量分数为49﹪,则水的体
积________100mL(填“大于”、“小于”、“等于”或“无法确定”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. SO2![]() CaSO3
CaSO3![]() CaSO4
CaSO4
B. Fe![]() Fe2O3
Fe2O3![]() FeCl3
FeCl3
C. HCl(aq)![]() Cl2
Cl2![]() Ca(ClO)2
Ca(ClO)2
D. Cu2(OH)2CO3![]() CuO
CuO![]() CuCl2(aq)
CuCl2(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以“物质的量”为中心的计算是化学计算的基础,下列与“物质的量”相关的计算正确的是( )
A. 现有CO、CO2、O3三种气体,它们分别都含有1 mol O,则三种气体的物质的量之比为3∶2∶1
B. 28 g CO和22.4 L CO2中含有的碳原子数一定相等
C. 标准状况下,11.2 L X气体分子的质量为16 g,则X气体的摩尔质量是32
D. a g Cl2中有b个氯原子,则阿伏加德罗常数NA的数值可表示为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式的是( )
A. 磁性氧化铁溶于足量的稀硝酸中:3Fe2++![]() +4H+===NO↑+3Fe3++2H2O
+4H+===NO↑+3Fe3++2H2O
B. 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液使![]() 恰好生成NH3·H2O:
恰好生成NH3·H2O:![]() +Al3++5OH-+
+Al3++5OH-+![]() +2Ba2+===NH3·H2O+
+2Ba2+===NH3·H2O+![]() +2H2O+2BaSO4↓
+2H2O+2BaSO4↓
C. 向少量的次氯酸钙溶液中通入过量的SO2气体:Ca2++2ClO-+2SO2+2H2O===CaSO4↓+4H++2Cl-+![]()
D. 向碳酸氢镁溶液中滴加过量的氢氧化钙溶液:Mg2++![]() +Ca2++2OH-===MgCO3↓+CaCO3↓+2H2O
+Ca2++2OH-===MgCO3↓+CaCO3↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向仅含SO![]() 、I-、Br-且物质的量分别为m、n、6 mol 的钠盐溶液中通入适量氯气,溶液中这三种离子的物质的量的变化如图所示。下列说法中正确的是( )
、I-、Br-且物质的量分别为m、n、6 mol 的钠盐溶液中通入适量氯气,溶液中这三种离子的物质的量的变化如图所示。下列说法中正确的是( )
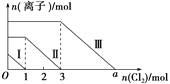
A. 曲线Ⅱ代表Br-的变化情况
B. 曲线Ⅰ对应的反应:SO![]() +Cl2+H2O===2H++SO
+Cl2+H2O===2H++SO![]() +2Cl-
+2Cl-
C. 通入的氯气为5 mol时,溶液中的主要阴离子为Cl-、SO![]()
D. 溶液中n(Na+)=n(SO![]() )+n(I-)+n(Br-)
)+n(I-)+n(Br-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL0.1mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中逐滴滴入0.1mol·L-1Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示。则下列说法中正确的是

A. a点时溶液中所含主要溶质为(NH4)2SO4
B. a→b段发生反应的离子方程式是 SO![]() +Ba2+===BaSO4↓
+Ba2+===BaSO4↓
C. b点为最大沉淀量,对应的纵坐标值为0.02
D. c点加入Ba(OH)2溶液的体积为200 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科大发现了人工合成金刚石的新方法,化学原理为:Na+CO2![]() C(金刚石)+C(石墨)+Na2CO3(未配平),这种合成具有深远的意义。下列说法不正确的是
C(金刚石)+C(石墨)+Na2CO3(未配平),这种合成具有深远的意义。下列说法不正确的是
A. 该反应中,钠作还原剂,二氧化碳作氧化剂
B. 每生成1mol Na2CO3时,共转移4mol电子
C. 该反应中Na2CO3是氧化产物
D. 还原性Na大于C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质:①Na;②NaCl溶液;③Na2O;④CO2溶液;⑤CO2;⑥NaOH;⑦Al2(SO4)3;⑧HCl;⑨BaSO4;⑩蔗糖
(1)属于电解质的是________________;属于非电解质的是________________;能导电的是_______。(用序号填写)
(2)0.5 mol SO2的质量是____ g。在标准状况下的体积为____L;含约________个氧原子。
(3)在Fe2O3+2Al![]() Al2O3+2Fe反应中,________元素的化合价升高,该元素的原子____(得到或失去)电子,_____________是氧化剂,______________是还原剂,________ 是还原产物,________是氧化产物。(填化学式)
Al2O3+2Fe反应中,________元素的化合价升高,该元素的原子____(得到或失去)电子,_____________是氧化剂,______________是还原剂,________ 是还原产物,________是氧化产物。(填化学式)
(4)请写出以下物质在水溶液中的电离方程式:
NaHCO3 _________________________; NaHSO4 __________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com