
【题目】下列说法正确的是
A. 分子式为C9H10O2的同分异构体中,苯环上连有一个甲基的酯类化合物有6种
B. 甲烷性质稳定,不能发生氧化反应
C. 苯和乙烯均能使溴水褪色,但褪色机理不同
D. 有机物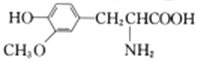 与
与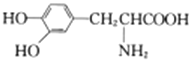 互为同系物
互为同系物
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5 min |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30 min |
(1)写出大试管中发生反应的化学方程式:_________________,该反应是______反应(填放热[或吸热)。
(2)实验结果表明,催化剂的催化效果与_____________________________有关。
Ⅱ.某可逆反应在某体积为5L的密闭容器中进行,在从0—3分钟各物质的量的变化情况如图所示(A,B,C均为气体)。
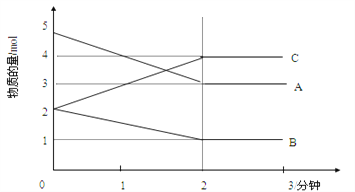
(3)该反应的的化学方程式为_____________________________________________;
(4)反应开始至2分钟时,B的平均反应速率为_____________________________。
(5)能说明该反应已达到平衡状态的是________________________。
a.v(A)= 2v(B)
b.容器内压强保持不变
c.2v逆(A)= v正(B)
d.容器内混合气体的密度保持不变
(6)在密闭容器里,通入a mol A (g)、b mol B (g)、c molC(g),发生上述反应,
当改变下列条件时,反应速率会减小的是____。
A.降低温度B.加入催化剂(正)C.增大容器体积
Ⅲ.(7)为了减缓过量Zn与盐酸产生氢气的反应速率而又不减少产生氢气的量,在盐酸中分别加入下列物质:
A.H2O
B.NaCl溶液
C.Na2CO3溶液
D.Na2NO3溶液
E.CuSO4粉末
你认为可行的是(填编号)________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,卤化银(AgX,X=Cl,Br)的2条溶解平衡曲线如图所示,已知AgCl,AgBr的Ksp依次减小,且p(Ag+)=-lgc(Ag+),p(X-)=-lgc(X-),利用pX-pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是
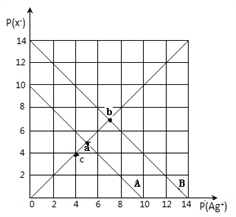
A. t℃时,c点可表示AgCl的不饱和溶液
B. B线表示的是AgBr
C. 取a、b两点处溶液等体积混合,维持t℃不变,混合溶液中一定无白色沉淀生成
D. 在t℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)平衡常数K≈104
AgBr(s)+Cl-(aq)平衡常数K≈104
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是

A. 该反应进行到M点放出的热量大于进行到W点放出的热量
B. T2下,在0~t1时间内,υ(Y)=a-b/t1 mol/(L·min)
C. M点的正反应速率υ(正)大于N点的逆反应速率υ(逆)
D. M点时再加入一定量的X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近期发现,H2S是继NO、CO之后第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为________________、______________,制得等量H2所需能量较少的是_____________(填“系统(Ⅰ)”或“系统(Ⅱ)”)。
(2)羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g) +H2O(g)。在610 k时,将1 mol CO2与1 mol H2S充入2 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g) +H2O(g)。在610 k时,将1 mol CO2与1 mol H2S充入2 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H2S的平衡转化率![]() =_______%,反应平衡常数K=________。
=_______%,反应平衡常数K=________。
②在620 K重复试验,平衡后水的物质的量分数为0.03,H2S的转化率![]() _____
_____![]() ,该反应的
,该反应的![]() H_____0。(填“>”“<”或“=”)
H_____0。(填“>”“<”或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是________(填标号)
A.N2 B.H2S C.COS D.CO2
(3)25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-) 关系如右图(忽略溶液体积的变化、H2S的挥发)。

①pH=13时,溶液中的c( H2S ) + c( HS- )=_____mol·L-1。
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH=______时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13 ]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列推断正确的是( )
A. BF3为三角锥形分子
B. NH的电子式为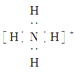 ,离子呈平面正方形结构
,离子呈平面正方形结构
C. CH4分子中的4个C—H键都是氢原子的1s轨道与碳原子的2p轨道形成的s—p σ键
D. CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成C—H σ键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 0.1mol/LC6H5ONa溶液中:c(Na+)>c(C6H5O-)>c(H+)>c(OH-)
B. Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小
C. 在Na2S溶液中加入AgC1固体,溶液中c(S2-)下降
D. pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分別取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液。在FeCl2溶液中需加入少量铁屑,其目的是___________。
(2)甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液変红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为____________。
(3)乙组同学认为甲组的实验不够谨慎,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是__________。
(4)丙组同学取10mL0.1mol/LKI溶液,加入6mL0.1mol/LFeCl3溶液混合。分別取2mL此溶液于3支武管中进行如下实验:
①第一支试管中加入1mLCCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是_______(填离子符号);实验①和实验③说明:在I-过量的情况下,溶液中仍含有_____(填离子符号);由此可以证明该氧化还原反应为___________。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为________。一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成,产生气泡的原因是__________。生成沉淀的原因是______________(用平衡移动原理解释)。
(6)某铁的氧化物(FexO)1.52g溶于足量盐酸中,向所得溶液通入标准状况下112mLCl2,恰好将Fe2+完全氧化,则x值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知电导率越大导电能力越强。常温下用0.100 mol·L-1NaOH溶液分别滴定10.00mL浓度均为0.100 mol·L-1的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示。下列说法正确的是

A. 曲线①代表滴定盐酸的曲线
B. 滴定醋酸的过程应该选择甲基橙作为指示剂
C. a、b、c三点溶液中水的电离程度:c>a>b
D. b点溶液中:c(OH-)>c(H+)+c(CH3COO-)+c(CH3COOH)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com