
【题目】下列推断正确的是( )
A. BF3为三角锥形分子
B. NH的电子式为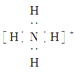 ,离子呈平面正方形结构
,离子呈平面正方形结构
C. CH4分子中的4个C—H键都是氢原子的1s轨道与碳原子的2p轨道形成的s—p σ键
D. CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成C—H σ键
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】氮化钠(Na3N)是一种重要的化合物,它与水作用可产生NH3。请回答下列问题:
(1)Na3N的电子式为______________________,该化合物是通过________键形成的。
(2)Na3N与盐酸反应生成________种盐,其电子式是_________________。
(3)Na3N与水的反应属于________反应。
(4)比较Na3N中两种粒子的半径大小________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微型直接甲醇燃料电池能量密度高,可应用于各类便携式电子产品,其工作原理如图所示。下列说法不正确的是
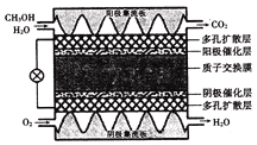
A. 多孔扩散层可起到传导电子的作用
B. 负极上直接通入无水甲醇可提高电池的比能量
C. 当电路中通过3mol e- 时,内电路中有3mol H+ 透过质子交换膜
D. 电池工作时,H+ 向阴极催化层迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定温度下,容积为0.5L的密闭容器中,将一定量的二氧化氮和二氧化硫气体混合后发生反应:SO2(g)+NO2(g) ![]() NO(g) +SO3(g)
NO(g) +SO3(g)
在上述平衡体系中通入少量O2,平衡 ________移动(填“向右”、“向左”或“不”); NO的浓度将_______(填“增大”、“减少”或“不变”),c(NO)与c(NO2)之和 ________(填“增大”、“减少”或“不变”)。
(2)高温时空气中的N2和O2会反应生成NO而污染大气:N2(g)+O2(g)===2NO(g)。估算自发进行的最低温度是__________℃。[已知该反应:ΔH=+180.50kJ/mol,ΔS=+247.7 J/(mol·K)]
(3)25 ℃时,将a mol·L-1氨水与0.01 mol·L-1盐酸等体积混合,反应平衡时溶液中c(NH![]() )=c(Cl-),则溶液显________(填“酸”、“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=________。
)=c(Cl-),则溶液显________(填“酸”、“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=________。
(4)用惰性电极电解M(NO3)x的水溶液,当阴极上增重a g时,在阳极上同时产生b L氧气(标准状况),从而可知M的相对原子质量为________________(用a、b、x表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 分子式为C9H10O2的同分异构体中,苯环上连有一个甲基的酯类化合物有6种
B. 甲烷性质稳定,不能发生氧化反应
C. 苯和乙烯均能使溴水褪色,但褪色机理不同
D. 有机物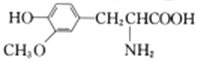 与
与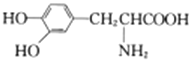 互为同系物
互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R、X、Y、Z是周期表前四周期元素,原子序数依次增大。R是宇宙中含量最多的元素,X、Y、Z三种元素的基态原子内层所有能级均已填满电子。X元素的基态原子的核外电子分布在三个能级上,且每个能级上排布了相同的电子数。Y与X同周期,且Y与X的基态原子中未成对电子数相同。Z的周期数比X的周期数多2,Z的基态原子最外层只有1个电子。回答下列问题:
(1)Z元素的价电子排布式为____________。
(2)R2Y可与Z的正二价离子形成一种复杂离子[Z(R2Y)4]2+,[Z(R2Y)4]2+的几何构型是______;将[Z(R2Y)4]2+与硫酸根形成的盐溶液装入试管中,逐滴加入氨水直至过量,出现的实验现象是______________。
(3)X与R可形成一种化学式为X3R4的不稳定化合物,是一种话性中间体,X3R4分子中3个X原子成直线排列,中间的X原子的杂化轨道类型为_____杂化。当X3R4分子中的4个R原子被其他4个不同种类元素的原子取代时,形成的新分子___(填“具有“或”不具有”)手性。
(4)下列排列方式中,通常条件下Z的晶体的堆积方式是______(填序号)。Z的晶体中,Z原子的配位数为________。
A.ABCABCABC B.ABABABABAB C.ABBAABBA D.ABCCBCABCCBA
(5)Z与F(氟)形成的一种化合物的晶胞结构如右图所示,若晶体密度为ag.cm-3,则Z与F(氟)最近距离为______pm(阿伏加德罗常数用NA表示,列出计算表达式,不用化简,1pm=1.0×10-12m)。
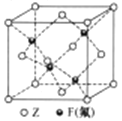
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验误差分析错误的是
A. 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
B. 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
C. 用润湿的pH试纸测稀碱溶液的pH,测定值偏小
D. 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系。该溶液的成分可能是
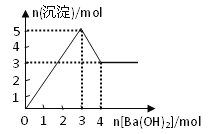
A. MgSO4 B. KAl(SO4)2 C. Al2(SO4)3 D. NaAlO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和水处理剂。以氯酸钠为原料制备亚氯酸钠的装置如下图所示(夹持装置省略)。

已知:
①纯ClO2易分解爆炸,空气中ClO2的体积分数在10%以下比较安全。
②NaClO2饱和溶液在温度低于38℃时析出晶体NaClO2·3H2O;高于38℃时析出NaClO2;高于60℃时NaClO2分解成NaClO3和NaCl。
(1)检查A装置气密性的方法是____________________________________。该装置中产生ClO2的化学方程式为_________________________________________。
(2)实验过程中需要持续通入空气,目的是_________________________________。
(3)NaClO2在碱性溶液中才能稳定存在,下列可用于检测三颈瓶中溶液酸碱性的是________(填代号)。
a.石蕊 b.酚酞 c.pH试纸 d.pH计
(4)B装置中发生反应的离子方程式为______________________________________;使用冰水浴的原因是_________________________________;反应结束后,从溶液中得到NaClO2固体的实验操作是____________________________________________________。
(5)NaClO2是一种高效水处理剂,在一定条件下可以将CN-氧化成两种无毒无害的气体。现用NaClO2处理10m3含CN-a mg·L-1的工业污水,理论上至少需要NaClO2的质量是___________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com