
【题目】R、X、Y、Z是周期表前四周期元素,原子序数依次增大。R是宇宙中含量最多的元素,X、Y、Z三种元素的基态原子内层所有能级均已填满电子。X元素的基态原子的核外电子分布在三个能级上,且每个能级上排布了相同的电子数。Y与X同周期,且Y与X的基态原子中未成对电子数相同。Z的周期数比X的周期数多2,Z的基态原子最外层只有1个电子。回答下列问题:
(1)Z元素的价电子排布式为____________。
(2)R2Y可与Z的正二价离子形成一种复杂离子[Z(R2Y)4]2+,[Z(R2Y)4]2+的几何构型是______;将[Z(R2Y)4]2+与硫酸根形成的盐溶液装入试管中,逐滴加入氨水直至过量,出现的实验现象是______________。
(3)X与R可形成一种化学式为X3R4的不稳定化合物,是一种话性中间体,X3R4分子中3个X原子成直线排列,中间的X原子的杂化轨道类型为_____杂化。当X3R4分子中的4个R原子被其他4个不同种类元素的原子取代时,形成的新分子___(填“具有“或”不具有”)手性。
(4)下列排列方式中,通常条件下Z的晶体的堆积方式是______(填序号)。Z的晶体中,Z原子的配位数为________。
A.ABCABCABC B.ABABABABAB C.ABBAABBA D.ABCCBCABCCBA
(5)Z与F(氟)形成的一种化合物的晶胞结构如右图所示,若晶体密度为ag.cm-3,则Z与F(氟)最近距离为______pm(阿伏加德罗常数用NA表示,列出计算表达式,不用化简,1pm=1.0×10-12m)。
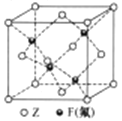
【答案】 3d104s1 平面四边形(或正方形) 首先形成蓝色沉淀,继续添加氨水,沉淀溶解。得到深蓝色透明溶液 sp 具有 a 12 ![]()
【解析】R、X、Y、Z是周期表前四周期元素,原子序数依次增大。R是宇宙中含量最多的元素氢元素,X、Y、Z三种元素的基态原子内层所有能级均已填满电子。X元素的基态原子的核外电子分布在三个能级上,且每个能级上排布了相同的电子数则电子排布式为1s22s22p2,为C 元素。Y与X同周期,且Y与X的基态原子中未成对电子数相同,则Y的电子排布式为1s22s22p4,即为氧元素。Z的周期数比X的周期数多2,Z的基态原子最外层只有1个电子则为铜元素。(1)Z为29号铜元素,价电子排布式为3d104s1;(2)R2Y即H2O,可与Z的正二价离子Cu2+形成一种复杂离子[Cu (H2O)4]2+,[Cu (H2O)4]2+铜离子核外电子排布式为1s22s22p63s23p63d9,[Cu(H2O)4]2+中心Cu2+离子是sp3d2杂化,是平面正方形;将[Cu (H2O)4]2+与硫酸根形成的盐溶液装入试管中,逐滴加入氨水直至过量,出现的实验现象是首先形成蓝色沉淀,继续添加氨水,沉淀溶解。得到深蓝色透明溶液;(3)X与R可形成一种化学式为C3H4的不稳定化合物,是一种活性中间体,C3H4分子中3个C原子成直线排列则为HC![]() C-CH3,中间的C碳原子价层电子对个数=σ键个数+孤电子对个数=2+
C-CH3,中间的C碳原子价层电子对个数=σ键个数+孤电子对个数=2+![]() ×(4-2×2)=2,采取sp杂化;当X3R4分子中的4个R原子被其他4个不同种类元素的原子取代时,形成的新分子具有手性;(4)Cu的晶体的堆积方式是面心立方最密堆积,答案选A;Cu的晶体中,Cu原子的配位数为12;(5)根据均摊法可知,每个晶胞中含有8×
×(4-2×2)=2,采取sp杂化;当X3R4分子中的4个R原子被其他4个不同种类元素的原子取代时,形成的新分子具有手性;(4)Cu的晶体的堆积方式是面心立方最密堆积,答案选A;Cu的晶体中,Cu原子的配位数为12;(5)根据均摊法可知,每个晶胞中含有8×![]() +6×
+6×![]() =4个铜原子,4个氟原子,Cu与F(氟)形成的一种化合物的晶胞结构如右图所示,若晶体密度为ag.cm-3,则晶胞边长为x,体积为x3,Z与F(氟)最近距离为
=4个铜原子,4个氟原子,Cu与F(氟)形成的一种化合物的晶胞结构如右图所示,若晶体密度为ag.cm-3,则晶胞边长为x,体积为x3,Z与F(氟)最近距离为![]() cm,
cm,![]() =a,解得x=
=a,解得x=![]() cm,Z与F(氟)最近距离为
cm,Z与F(氟)最近距离为![]() cm=
cm=![]() ×1010pm。
×1010pm。


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述错误的是
A. 室温下,pH=12的Ba(OH)2溶液中Ba2+的数目为5×10-3NA
B. 14g乙烯和14g丙烯中含有的共用电子对数均是3NA
C. 1 mol FeI2与一定量氯气反应时,若有0.5mol Fe2+被氧化则转移的电子数为2.5NA
D. 0.4mol AgNO3受热完全分解(2AgNO3![]() 2Ag+2NO2↑+O2↑),用排水法最终收集到气体的分子数为0.1NA
2Ag+2NO2↑+O2↑),用排水法最终收集到气体的分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是( )

A. a点由水电离出的c(H+)=1.0×10-14 mol·L-1
B. b点:c(NH![]() )+c(NH3·H2O)=c(Cl-)
)+c(NH3·H2O)=c(Cl-)
C. c点:c(Cl-)=c(NH![]() )
)
D. d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】湖北随州安陆等地区盛产银杏,银杏叶具有敛肺平喘、活血化淤、止痛的作用,是一种珍贵的中药材。对银杏叶活性成分黄酮类物质的提取常用的技术有溶剂提取法、蒸馏法、升华法、结晶法、超声波提取法等。下列关于分离提纯实验仪器和操作正确的是
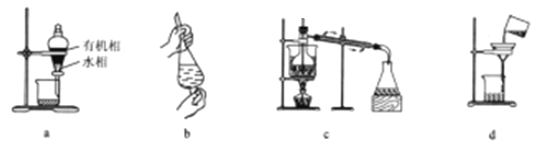
A. 用装置a分液,放出水相后再从分液漏斗下口放出有机相
B. 操作b:银杏油粗产品从银杏叶中分离后,用有机溶剂萃取其中的有效成分,振荡过程中不时地旋开活塞使漏斗内气体放出
C. 用装置c进行蒸馏操作,将有机溶剂分离出去得到银杏叶有效成分黄酮类物质
D. 结晶后利用装置d将晶体与溶剂分离开
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列推断正确的是( )
A. BF3为三角锥形分子
B. NH的电子式为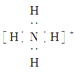 ,离子呈平面正方形结构
,离子呈平面正方形结构
C. CH4分子中的4个C—H键都是氢原子的1s轨道与碳原子的2p轨道形成的s—p σ键
D. CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成C—H σ键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从实验测得不同物质中氧氧之间的键长和键能的数据:
O—O键 数据 | O | O | O2 | O |
键长(10-12 m) | 149 | 128 | 121 | 112 |
键能(kJ·mol-1) | x | y | z=494 | w=628 |
其中x、y的键能数据尚未测定,但可根据规律性推导键能的大小顺序为w>z>y>x;该规律性是
A.成键的电子数越多,键能越大
B.键长越长,键能越小
C.成键所用的电子数越少,键能越大
D.成键时电子对越偏移,键能越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、为测定金属钠样品(表面有 Na2O)中钠单质的质量分数,设计了如下实验(反应装置如图所示):

①称量 A、B 的总质量
②称取一定质量的钠样品
③将钠样品投入锥形瓶中,迅速塞紧带 U 形干燥管(内含无水 CaCl2 干燥 剂)的橡皮塞 。有关数据是:称取的金属钠样品质量为 a g,A、B 反应前总质量为 b g,反应后 A、B 的总质量为 c g。 请根据题意回答下列问题:
(1)A 中钠和水反应过程可看到钠熔成闪亮的小球,产生这一现象原因是:_____________
(2)用 a、b、c 表示的钠单质的质量分数为_______________
(3)如果没有 B 装置对实验结果有何影响___________。(填“偏大”或“偏小”“不影响”)
Ⅱ、现用金属钠和空气制备纯度较高的 Na2O2,可利用的装置如下图。回答下列问题:


(4)上述装置Ⅳ中盛放的试剂是______,为完成实验应将装置Ⅳ接在_____(填写字母号)。
A.I 之前 B. I 和 II 之间 C. II 和 III 之间 D.III 之后
(5)点燃酒精灯后,观察到装置 II 中的现象为_____。
Ⅲ、现用制得纯度较高的 Na2O2进行相关实验。回答下列问题:
(6)用脱脂棉包住Na2O2粉末,置于石棉网上,通过细管向脱脂棉中吹CO2,脱脂棉_______(填“能”或“不能”)燃烧起来。
(7)盛有0.78 g Na2O2、1.68g NaHCO3的固体混合物放在密闭容器中加热,最后固体质量为_________g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是发展中的新能源,它的利用包括氯的制备、应用等环节。回答下列问题:
(1)氢气的制备
以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如图所示。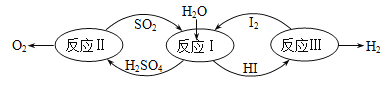
反应Ⅱ包含两步反应:
①H2SO4(1)=SO3(g)+H2O(g) ΔH=177kJ/mol
②2SO3(g)=2SO2(g)+O2(g) △H=196kJ/mol
写出反应Ⅱ的热化学反应方程式__________
(2)氯气的应用
CO2加氢制备甲酸(HCOOH)可用于回收利用CO2。温度为T1时,将等物质的量的CO2和H2充入体积为1L的密闭容器中发生反应:CO2(g)+H2(g)![]() HCOOH(g) △H,化学平衡常数K=1
HCOOH(g) △H,化学平衡常数K=1
实验测得:v正=k正·c(CO2)·c(H2), v逆=k逆·c(HCOOH),k正、k逆为速率常数。
①当CO2的转化率为33.3%时,HCOOH的体积分数为_____(保留整数)。
②T1时,k逆=_________(用k正表示)。当升高温度至T2时,k逆=0.9k正,则△H____0(填“>”、“<"或“=”)。
③采用电还原法也可将CO2转化为甲酸根,用Sn为阴极、Pt为阳极,KHCO3溶液为电解液进行电解。CO2应通入______区(填“阳极”或“阴极”),其电极反应式为__________
④可用NaHCO3代替CO2作为碳源加氢制备甲酸。向反应器中加入NaHCO3水溶液、A1粉、Cu粉,在300℃下反应。NaHCO3用量一定时,Al、Cu的用量对碳转化量影响结果如图。由图可知,曲线d相对其它三条曲线碳转化量变化不大的主要原因是__________,当碳转化量为30%时所采用的实验条件是____________。
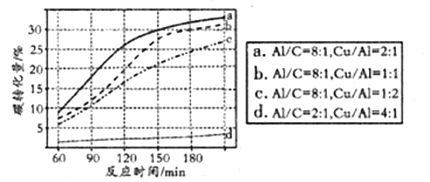 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用足量的一氧化碳还原4.64 g某金属氧化物,把生成的二氧化碳全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.0 g,则此金属氧化物是下列中的( )
A. 氧化铜 B. 氧化铁 C. 四氧化三铁 D. 二氧化锰
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com