
【题目】室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是( )

A. a点由水电离出的c(H+)=1.0×10-14 mol·L-1
B. b点:c(NH![]() )+c(NH3·H2O)=c(Cl-)
)+c(NH3·H2O)=c(Cl-)
C. c点:c(Cl-)=c(NH![]() )
)
D. d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】N2O4是一种无色气体,常被用作火箭推进剂组分中的氧化剂。
(1)已知:①2O2(g)+N2(g)![]() N2O4(l) △H1;
N2O4(l) △H1;
②N2O4 (l)+O2(g)![]() N2(g)+2H2O(g) △H2;
N2(g)+2H2O(g) △H2;
联氨和从N2O4作为火箭推进剂时发生反应:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) 的△H=_________(用含△H1、△H2的式子表示)。
(2)一定温度下,在容积为2L的恒容密闭容器中充入xmolN2O4(g),发生反应:N2O4(g)![]() 2NO2(g) △H=+24.4kJ/mol。体系中NO2浓度随时间变化的情况如图所示。
2NO2(g) △H=+24.4kJ/mol。体系中NO2浓度随时间变化的情况如图所示。

①下列可作为判断反应达到平衡的依据是_______ (填序号)。
a.v正(N2O4)=2v逆(NO2). b.体系颜色不变
c.气体平均相对分子质量不变 d.气体密度不变
② ta时,v正_________v逆(填“>”“ =”或“<”,下同);ta时v逆____________tb时v逆。
③该反应的平衡常数K=__________。
④对于气体参与的反应,平衡常数也可用气体组分(B)的平衡分压p(B)代替该气体的平衡浓度c(B),
则该反应平衡常数KP=_____________ (用表达式表示);已知:上述反应中,正反应速率为v正=k正·p(N2O4),逆反应速率v逆= k逆·p2(NO2),其中k正、k逆为速率常数,则k正为_______________以k逆、KP表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是周期表中的一部分,根据A﹣I在周期表中的位置,第(1)~(4)小题用元素符号或化学式回答,(5)~(8)小题按题目要求回答.
族 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
1 | A | |||||||
2 | D | E | G | I | ||||
3 | B | C | F | H |
(1)表中元素,化学性质最不活泼的是 , 只有负价而无正价的是 , 氧化性最强的单质是 , 还原性最强的单质是 .
(2)最高价氧化物的水化物碱性最强的是 , 酸性最强的是 , 呈两性的是 .
(3)A分别与D,E,F,G,H形成的化合物中,最稳定的 ,
(4)在B,C,E,F,G,H中,原子半径最大的是 ,
(5)A和D组成最简单化合物的电子式 ,
(6)A和E组成化合物的化学式 ,
(7)用电子式表示B和H组成化合物的形成过程: .
(8)B的最高价氧化物的水化物和C的最高价氧化物相互反应的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出元素在周期表中的位置,离子结构示意图以及粒子半径大小比较
(1)Al元素在周期表中的位置;S元素在周期表中的位置 .
(2)S2﹣电子式
(3)粒子半径比较:Mg2+O2﹣ , Mg2+Ca2+ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有________________________________________________。
(2)硫酸铜溶液可以加快氢气生成速率的原因是__________________________________________。
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是________;
(4)要加快上述实验中气体产生的速率,还可采取的措施有______________(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需的时间。
A | B | C | D | E | F | |
4 mol·L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1=________,V6=________,V9=________。
②反应一段时间后,实验E中的金属呈________色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,既能发生水解反应,又能发生加成反应,但不能发生消去反应的是( )
A.CH2=CH—CH2CH2ClB.CH2=CHCH2COOCH3
C.CH3CHClCH=CH2D.(CH3)3CCH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D四种短周期元素,原子序数D>A>B>C,且A,B同周期,C,D同主族,A的原子结构示意图为: 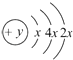 ,B最外层电子数是2,C的气态氢化物的水溶液呈碱性,据此填空:
,B最外层电子数是2,C的气态氢化物的水溶液呈碱性,据此填空:
(1)A的元素名称为 , 其气态氢化物的稳定性比CH4(填“强”或“弱”).
(2)C,D的最高价氧化物的水化物的酸性大小为>(填化学式).
(3)B的活泼性比钙的(填“强”或“弱”).
(4)写出C的气态氢化物与其最高价氧化物对应的水化物反应 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中化学键的类型相同的是( )
A. HCl、MgCl2、NH4Cl B. NH3、H2O、CO2
C. H2O、Na2O、CO2 D. CaCl2、NaOH、H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com