
| A、少量稀盐酸 |
| B、氯化钙溶液 |
| C、氢氧化钠溶液 |
| D、氯化钡溶液 |
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
| A、乙醇与浓硫酸混合加热至170℃ |
| B、由苯制取六氯环己烷(C6H6Cl6) |
| C、甲苯与浓硫酸、浓硝酸混合 |
| D、2-甲基-1,3-丁二烯与溴水混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、V(N2)=0.5mol/(L-min) |
| B、v(H2)=1.5mol/(L-min) |
| C、v(NH2)=1mol/(L-min) |
| D、v(N2)=1mol/(L-min) |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、固体A主要是SiO2 |
| B、固体X主要是Fe(OH)3和Mg (OH)2 |
| C、滤液D中通入过量CO2发生的主要反应为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3 |
| D、滤液E中含有NaHCO3,NaHCO3是焙制糕点所用的发酵粉的主要成分之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:
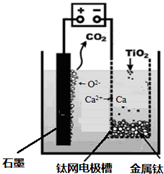
 观察图,讨论:
观察图,讨论:查看答案和解析>>
科目:高中化学 来源: 题型:
 工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
工业上利用CO和水蒸气在一定条件下发生反应制取氢气:| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q | |
| 4 |
| Vt1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t1~t2 | t3~t4 | t4~t5 | t6~t7 |
| K1 | K2 | K3 | K4 |
| CO2%∽CO%~H2 (体积分数) |
0-30-70 | 2-28-70 | 4-26-70 | 8-22-70 | 20-10-70 | |||||||||||
| 反应温度/℃ | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | |
| 碳转化率(%) | CHOH | 4.9 | 8.8 | 11.0 | 36.5 | 50.7 | 68.3 | 19.0 | 33.1 | 56.5 | 17.7 | 33.4 | 54.4 | 8.0 | 12.0 | 22.6 |
| CH | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2.8 | 2.8 | 2.8 | |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com