
已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,回答下列问题:
(1)该溶液中c(H+)= 。
(2)HA的电离平衡常数K= ;
(3)升高温度时,K (填“增大”,“减小”或“不变”)。
(4)由HA电离出的c(H+)约为水电离出的c(H+)的 倍。
 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:单选题
某温度下, pH值相同的盐酸和氯化铵溶液分别稀释,平衡pH值随溶液体积变化的曲线如下图所示。据图判断下列叙述中,正确的是( )
| A.Ⅱ为氯化铵稀释时pH值变化曲线,a点水的电离程度大于c点水的电离程度 |
| B.b点溶液中水的电离程度比c点溶液中水的电离程度大,且两点的KW相同 |
| C.a点时,等体积的两溶液与NaOH反应消耗的NaOH量相同 |
| D.加入足量NaOH,b点溶液消耗的NaOH比d点溶液消耗的多 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
锅炉水垢既会降低燃料的利用率、影响锅炉的使用寿命,还可能造成安全隐患。
某锅炉水垢的主要成分有CaCO3、CaSO4、Mg(OH)2、Fe2O3,用酸洗法可除去该水垢,其基本原理如下图所示。
(1)酸洗时,为使水垢尽可能溶解,不宜选用的是 (填标号)。
| A.醋酸 | B.盐酸 | C.硝酸 | D.稀硫酸 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
【化学与技术】
电镀厂镀铜废水中含有CN-和Cr2O72-离子,需要处理达标后才能排放。该厂拟定下列流程进行废水处理,回答下列问题: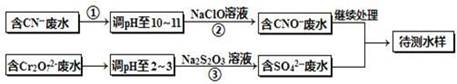
(1)上述处理废水流程中主要使用的方法是______。
(2)②中反应后无气体放出,该反应的离子方程式为 。
(3)步骤③中,每处理0.4mol Cr2O72-时转移电子2.4mol,该反应离子方程式为 。
(4)取少量待测水样于试管中,加入NaOH溶液,观察到有蓝色沉淀生成,再加Na2S溶液,蓝色沉淀转化成黑色沉淀,请使用化学用语和文字解释产生该现象的原因 。
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于FeII[FeCr]O4(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4?7H2O,下列结论正确的是_______。
| A.x ="0.5" ,a =8 | B.x =0.5,a = 10 |
| C.x =" 1.5" ,a =8 | D.x =" 1.5" ,a = 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分).钛白粉(主要成分是TiO2),广泛用于油漆、塑料、造纸等行业,还可用作乙醇脱水、脱氢的催化剂。工业上常以钛矿石(主要成分为FeTiO3(钛酸亚铁),并含FeO、A12O3、 SiO2等杂质)为主要原料经过以下流程制得TiO2,并获得副产品FeSO4·7H2O.
请回答下列问题:
(l)步骤I的目的是
(2)写出步骤Ⅱ中FeTiO3与H2SO4反应的化学方程式 。
(3)步骤II中经过 、 、过滤、洗涤等操作可以得到FeSO4·7H2O.晶体,还可以利用酸化的FeSO4溶液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水).该反应的离子方程式为
(4)请结合化学用语用化学平衡理论解释步骤III中将TiOSO4转化为H2TiO3的原理:
(5)为测定步骤II后溶液中TiOSO4的含量,首先取待测钛液10 mL加水稀释至100 mL,再加过量铝粉,充分振荡,使其完全反应:3TiO2++Al+6H+=3Ti3++Al3++3H2O。过滤后,取出滤液20.00 mL,以KSCN溶液为指示剂,用0.1000 mol·L-1 NH4Fe(SO4)2溶液滴定至终点,再重复2次,测得平均值为30.00mL。
①该滴定达到终点时的现象
②待测钛液中TiOSO4的物质的量浓度是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。②K (Ni(OH)
(Ni(OH) ): 5.0×10-16 ,K
): 5.0×10-16 ,K (NiC2O4): 4.0×10-10
(NiC2O4): 4.0×10-10
回答下列问题:
(1)酸溶后所留残渣的主要成份 (填物质名称)。
(2)用NiO调节溶液的pH,析出沉淀的成分为____________________(填化学式);用pH试纸测定某溶液pH的具体操作是 。
(3)写出加入Na2C2O4溶液后反应的化学方程式_____________________________。
(4)写出加入NaOH溶液所发生反应的离子方程式 ,该反应的平衡常数为 。
(5)沉淀Ⅲ可被电解所得产物之一 (填化学式)氧化生成Ni(OH)3 ,如何洗涤Ni(OH)3 沉淀?
。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知:难溶电解质Cu(OH)2在常温下的Ksp=2×10-20,则常温下:
(1)某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于________。
(2)要使0.2 mol·L-1 CuSO4溶液中的Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液的pH为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)25 ℃时,0.1 mol·L-1 NaOH溶液的pH为 ;
(2)25 ℃时,0.1 mol·L-1 NH4Cl溶液的pH 7(填“<”“=”或“>”),其原因是 (用离子方程式表示);
(3)将上述两种溶液等体积混合后,离子浓度大小次序正确的是 (填序号)。
| A.c(Na+)>c(Cl-)>c(OH-)>c(H+) |
| B.c(Na+)=c(Cl-)>c(H+)>c(OH-) |
| C.c(Na+)=c(Cl-)>c(OH-)>c(H+) |
| D.c(Cl-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | HB物质的量浓度(mol/L) | KOH物质的量浓度(mol/L) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c1 | 0.2 | pH=7 |
| 丙 | 0.1 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com