
【题目】硅是重要的半导体材料,构成现代电子工业的基础。硅及其化合物在工业中应用广泛,在国防和航天工业中亦有许多用途。
(1)硅原子中最外层电子排布式为___,该层电子的电子云有___种不同的伸展方向。
(2)温石棉矿是一种硅酸盐类矿物,化学式写作氧化物形式为6MgO4SiO24H2O,其中原子半径最大的元素在周期表中的位置是___。SiO2存在与金刚石结构类似的晶体,其中硅氧原子之间以___相结合。
a.离子键 b.极性键 c.非极性键 d.范德华力
(3)甲硅烷(SiH4)是一种无色的液体,遇到空气能爆炸性自燃,生成二氧化硅固体和水。在室温下,10gSiH4自燃放出热量446kJ,请写出其燃烧的热化学方程式:___;
(4)SiH4的热稳定性不如CH4,其原因是___。
工业上硅铁可以用于冶镁。以煅白(CaOMgO)为原料与硅铁(含硅75%的硅铁合金)混合,置于密闭设备中于1200℃发生反应:2(CaOMgO)(s)+Si(s)![]() Ca2SiO4(l)+2Mg(g)
Ca2SiO4(l)+2Mg(g)
(5)常温下镁的还原性强于硅。上述方法能够获得镁的原因是:___。
(6)若上述反应在容积为aL的密闭容器中发生,一定能说明反应已达平衡的是___(选填编号)。
a.反应物不再转化为生成物
b.炉内Ca2SiO4与CaOMgO的质量比保持不变
c.反应放出的总热量不再改变
d.单位时间内,n(CaOMgO)消耗:n(Ca2SiO4)生成=2:1
若bg煅白经tmin反应后转化率达70%,该时段内Mg的生成速率是___。
【答案】2s22p2 3 第三周期第ⅡA族 b SiH4(l)+2O2(g)=SiO2(s)+2H2O(l) ![]() -1427.2kJ/mol 非金属性C>Si,它们的气态氢化物的热稳定性CH4>SiH4; 1200℃时反应生成的镁以蒸气的形式逸出,使平衡向正反应方向移动 bc
-1427.2kJ/mol 非金属性C>Si,它们的气态氢化物的热稳定性CH4>SiH4; 1200℃时反应生成的镁以蒸气的形式逸出,使平衡向正反应方向移动 bc ![]()
【解析】
(1)Si原子序数为14,最外层3个电子层,最外层电子数为4,故最外层电子排布式为:2s22p2;该原子中含有3个s轨道、6个p轨道,s能级电子云的形状为球形,无伸展方向,p层共有3种伸展方向,故答案为:2s22p2;3;
(2)6MgO4SiO24H2O中原子半径最大的元素是Mg,在周期表中的位置是第三周期第ⅡA族,SiO2中硅氧原子之间以极性共价键相结合,故答案为:第三周期第ⅡA族;b;
(3)![]() ,则1molSiH4燃烧放出的热量为:
,则1molSiH4燃烧放出的热量为:![]() ,其燃烧的热化学方程式:SiH4(l)+2O2(g)=
,其燃烧的热化学方程式:SiH4(l)+2O2(g)=
SiO2(s)+2H2O(l) ![]() -1427.2kJ/mol,故答案为:SiH4(l)+2O2(g)=SiO2(s)+2H2O(l)
-1427.2kJ/mol,故答案为:SiH4(l)+2O2(g)=SiO2(s)+2H2O(l) ![]() -1427.2kJ/mol;
-1427.2kJ/mol;
(4)根据元素周期律,非金属性C>Si,则它们的气态氢化物的热稳定性CH4>SiH4,故答案为:非金属性C>Si,它们的气态氢化物的热稳定性CH4>SiH4;
(5)1200℃时发生反应为2(CaOMgO)(s)+Si(s)![]() Ca2SiO4(l)+2Mg(g),此时镁以蒸气的形式逸出,使平衡向正反应方向移动,使得化学反应能发生,故答案为:1200℃时反应生成的镁以蒸气的形式逸出,使平衡向正反应方向移动;
Ca2SiO4(l)+2Mg(g),此时镁以蒸气的形式逸出,使平衡向正反应方向移动,使得化学反应能发生,故答案为:1200℃时反应生成的镁以蒸气的形式逸出,使平衡向正反应方向移动;
(6)a.化学平衡是动态平衡,反应物不再转化为生成物,则是证明反应结束的,a错误;
b.炉内Ca2SiO4与CaOMgO的质量比保持不变,达到了平衡,b正确;
c.反应放出的热量不再改变,证明正逆反应速率是相等的,各个组分的浓度不随时间的变化而改变,c正确;
d.单位时间内,n(CaOMgO)消耗:n(Ca2SiO4)生成=2:1,不能证明正逆反应速率相等,d错误,
Mg的生成速率![]() ,故答案为:bc;
,故答案为:bc;![]() ;
;


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】25℃时,将 1.0 L w mol·L-1 CH3COOH 溶液与 0.1 mol NaOH固体混合,充分反应。然后向混合液中加入CH3COOH或CH3COONa固体(忽略体积和温度变化),溶液pH的变化如图。下列叙述正确的是
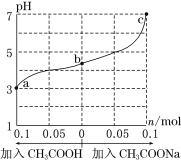
A.b点混合液中c(Na+)>c(CH3COO-)
B.加入CH3COOH过程中,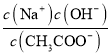 增大
增大
C.c点存在:c(CH3COOH)+c(CH3COO-) =0.1+w
D.a、b、c对应的混合液中,水的电离程度由大到小的顺序是c>a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度.则下列说法正确的是( )
A.物质的量:甲<乙B.气体体积:甲>乙
C.摩尔体积:甲>乙D.相对分子质量:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是在实验室模拟“侯氏制碱法”生产流程的示意图:则下列叙述错误的是( )
![]()
则下列叙述错误的是
A.A气体是NH3,B气体是CO2
B.把纯碱及第Ⅲ步所得晶体与某些固体酸性物质(如酒石酸)混合可制泡腾片
C.第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒
D.第Ⅳ步操作是将晶体溶于水后加热、蒸发、结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上苯乙烯是合成树脂、离子交换树脂及合成橡胶等的重要单体,如图是苯乙烯的结构简式:![]() ,下列关于该有机物的说法不正确的是( )
,下列关于该有机物的说法不正确的是( )
A. 苯乙烯的分子式为C8H8
B. 苯乙烯通过加聚反应可制备高分子化合物
C. 苯乙烯与溴的四氯化碳溶液反应:![]()
D. 苯乙烯能发生加成反应,但不能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下述转化关系,回答问题:

已知:①+CH3Br![]() CH3+HBr;
CH3+HBr;
②C物质苯环上一卤代物只有两种。
(1)写出B物质的名称__________;D物质的结构简式________。
(2)写出反应②的类型________;反应⑤的条件________。
(3)写出反应⑥的化学方程式:________________________________。
(4)写出D+E反应的化学方程式:_______________。
(5)反应②还有可能生成一种C16H18的有机物,其苯环上一卤代物也只有两种,写出它的结构简式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
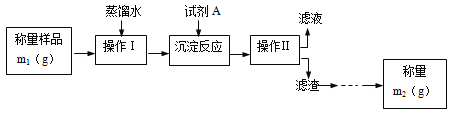
【题目】为了测定工业纯碱中Na2CO3的质量分数(含少量NaCl),甲、乙、丙三位学生分别设计了一套实验方案。
学生甲的实验流程如图所示:
学生乙设计的实验步骤如下:
①称取样品,为1.150g;②溶解后配成250mL溶液;③取20mL上述溶液,加入甲基橙2~3滴;④用0.1140mol/L的标准盐酸进行滴定;⑤数据处理。
回答下列问题:
(1)甲学生设计的定量测定方法的名称是___法。
(2)试剂A可以选用___(填编号)
a.CaCl2 b.BaCl2 c.AgNO3
(3)操作Ⅱ后还应对滤渣依次进行①___、②___两个实验操作步骤。其中,证明前面一步的操作已经完成的方法是___;
(4)学生乙某次实验开始滴定时,盐酸溶液的刻度在0.00mL处,当滴至试剂B由___色至___时,盐酸溶液的刻度在14.90mL处,乙同学以该次实验数据计算此样品中Na2CO3的质量分数是___(保留两位小数)。乙同学的这次实验结果与老师给出的理论值非常接近,但老师最终认定他的实验方案设计不合格,你认为可能的原因是什么?___。
(5)学生丙称取一定质量的样品后,只加入足量未知浓度盐酸,经过一定步骤的实验后也测出了结果。他的实验需要直接测定的数据是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中有S2-、SO32-、Br-、I-四种阴离子各0.1mol。现通入Cl2,则通入Cl2的体积(标准状况)和溶液中相关离子的物质的量的关系图正确的是
A.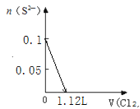 B.
B.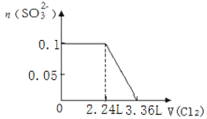
C.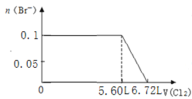 D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在银球和铁球之间用铂丝连接,用一根绝缘的细丝悬挂,使之平衡(如图),然后小心地从烧杯中央滴入CuSO4溶液。下列说法正确的是
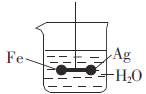
A.铁球降低,银球升高
B.铁球升高,银球降低
C.铁球表面出现红色物质
D.银球表面无任何现象
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com