
分析 (1)碳酸钙与盐酸反应生成氯化钙和水、二氧化碳;
(2)硫酸与氢氧化钠反应生成硫酸钠和水;
(3)氯化钡与硫酸钠反应生成硫酸钡沉淀和氯化钠;
解答 解:(1)碳酸钙与盐酸反应生成氯化钙和水、二氧化碳,化学方程式:CaCO3+2HCl═CaCl2+H2O+CO2↑,离子方程式:CaCO3+2H+═Ca2++H2O+CO2↑;
故答案为:CaCO3+2HCl═CaCl2+H2O+CO2↑、CaCO3+2H+═Ca2++H2O+CO2↑;
(2)硫酸与氢氧化钠反应生成硫酸钠和水,化学方程式:2NaOH+H2SO4═2H2O+Na2SO4,离子方程式:OH-+H +═H2O;
故答案为:2NaOH+H2SO4═2H2O+Na2SO4、OH-+H +═H2O;
(3)氯化钡与硫酸钠反应生成硫酸钡沉淀和氯化钠,化学方程式:Na2SO4+BaCl2═BaSO4↓+2NaCl,离子方程式:SO42-+Ba2+═BaSO4↓;
故答案为:Na2SO4+BaCl2═BaSO4↓+2NaCl、SO42-+Ba2+═BaSO4↓.
点评 本题考查了离子方程式、化学方程式的书写,明确反应实质是解题关键,注意化学式的拆分,注意反应应遵循客观事实.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:选择题
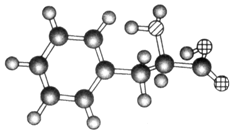
| A. | 该物质的结构简式为 | |
| B. | 该物质可以发生加成反应 | |
| C. | 该物质既可以与强酸反应也可以与强碱反应 | |
| D. | 该物质可以聚合成高分子物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
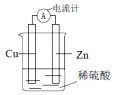
| A. | 该装置中能量转化方式为电能转化为化学能 | |
| B. | 电子从锌片流出,经导线流向铜片 | |
| C. | 工作一段时间之后,溶液颜色逐渐变蓝 | |
| D. | 锌片发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 甲 | 乙 | 丙 |
| 反应物的投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 |
| NH3的浓度(mol•L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 体系的压强(Pa) | p1 | p2 | p3 |
| 反应物的转化率 | a1 | a2 | a3 |
| A. | a+b=92.4 | B. | 2c1>c3 | C. | 2p2<p3 | D. | α1+α3=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
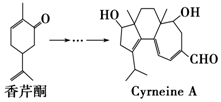 CyrneineA对治疗神经系统疾病有着很好的疗效,制备CyrneineA可用香芹酮经过多步反应合成:下列说法不正确的是( )
CyrneineA对治疗神经系统疾病有着很好的疗效,制备CyrneineA可用香芹酮经过多步反应合成:下列说法不正确的是( )| A. | 香芹酮化学式为C10H14O | |
| B. | CyrneineA可以发生加成反应、消去反应和氧化反应 | |
| C. | 香芹酮和CyrneineA均能使酸性KMnO4溶液褪色 | |
| D. | 与香芹酮互为同分异构体,分子中有4种不同化学环境的氢原子的酚类化合物共有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl在饱和NaCl溶液中的Ksp比在纯水中的Ksp小 | |
| B. | 向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动 | |
| C. | 将0.001 mol•L-1AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4溶液中先产生Ag2CrO4沉淀 | |
| D. | 向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl)<Ksp(AgBr) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com