
分析 (1)根据c=$\frac{n}{V}$分析操作对溶质的物质的量或对溶液的体积的影响判断,如果n偏大或V偏小都导致配制溶液的物质的量浓度偏高;
(2)容量瓶用于配制一定体积、浓度的溶液,且在常温下使用;
(3)根据n=$\frac{m}{M}$计算物质的量,根据c=$\frac{n}{V}$计算浓度,注意溶液为均一稳定的分散系的特点;
(4)溶液、浊液、胶体三种分散系的本质区别为分散质粒子的直径大小;
(5)反应中Mn元素化合价降低,被还原,Cl元素化合价升高,被氧化.
解答 解:(1)a.容量瓶在使用前内壁沾有水珠,对实验无影响,故a错误;
b.定容时俯视读刻度,导致体积偏小,则浓度偏大,故b正确;
c.未冷却至室温就注入容量瓶并马上定容,导致体积偏小,浓度偏大,故c正确;
d.向容量瓶转移液体时有少量流出,导致浓度偏小,故d错误.
故答案为:bc;
(2)容量瓶是用来配制一定物质的量浓度溶液的定量仪器,容量瓶上标有使用温度、容量和刻度,故答案为:①③⑤;
(3)n(NaOH)=$\frac{4g}{40g/mol}$=0.1mol,c=$\frac{0.1mol}{1L}$=0.1mol/L,从中取出10ml,这10ml溶液的物质的量浓度是0.1mol/L,故答案为:0.1 mol/L;
(4)根据分散质微粒直径大小来分类,把分散系划分为:溶液(小于1nm)、胶体(1nm~100nm)、浊液(大于100nm),所以,溶液、胶体和浊液这三种分散系的本质区别在于分散质粒子直径大小,光束通过Fe(OH)3胶体时,可看到光亮的通路,这种现象叫丁达尔现象,故答案为:B;丁达尔现象;
(5)反应中Mn元素化合价降低,被还原,还原产物为MnCl2,Cl元素化合价升高,被氧化,故答案为:Cl;MnCl2.
点评 本题考查较为综合,涉及溶液的配制、物质的量浓度的计算以及氧化还原反应等,为高频考点,侧重于学生的分析、计算能力的考查,注意把握溶液的特点以及相关计算公式的运用,难度不大.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 $→_{①}^{Cl_{2},光照}$
$→_{①}^{Cl_{2},光照}$ $→_{②}^{NaOH,乙醇,△}$A$→_{③}^{溴水}$B$\stackrel{④}{→}$
$→_{②}^{NaOH,乙醇,△}$A$→_{③}^{溴水}$B$\stackrel{④}{→}$ $→_{⑤}^{Br_{2},催化剂}$
$→_{⑤}^{Br_{2},催化剂}$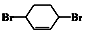 $\stackrel{⑥}{→}$
$\stackrel{⑥}{→}$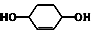
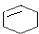 ,B的结构简式是
,B的结构简式是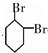 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Ca2+、Al3+、HCO3-、Cl- | B. | K+、Ba2+、Cl-、NO3- | ||
| C. | Na+、AlO2-、OH-、SO42- | D. | Na+、NH4+、Cl-、K+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com