

分析 C与D反应生成乙酸乙酯,则C、D分别为乙酸、乙醇中的一种,A与水反应生成C,A氧化生成D,且A与氢气发生加成反应生成B,可推知A为CH2=CH2,与水在一定条件下发生加成反应生成C为CH3CH2OH,乙烯氧化生成D为CH3COOH,乙烯与氢气发生加成反应生成B为CH3CH3.(4)中某烃X与B(乙烷)是同系物,分子中碳与氢的质量比为36:7,则C、H原子数目之比为$\frac{36}{12}$:$\frac{7}{1}$=3:7=6:14,故X为C6H14.
解答 解:C与D反应生成乙酸乙酯,则C、D分别为乙酸、乙醇中的一种,A与水反应生成C,A氧化生成D,且A与氢气发生加成反应生成B,可推知A为CH2=CH2,与水在一定条件下发生加成反应生成C为CH3CH2OH,乙烯氧化生成D为CH3COOH,乙烯与氢气发生加成反应生成B为CH3CH3.
(1)C为CH3CH2OH,含有的官能团为羟基,故答案为:羟基;
(2)A→D是乙烯发生氧化反应生成乙酸,故选:C;
(3)C与D反应是乙醇与乙酸发生酯化反应生成乙酸乙酯,反应方程式为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,
故答案为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;
(4)某烃X与B(乙烷)是同系物,分子中碳与氢的质量比为36:7,则C、H原子数目之比为$\frac{36}{12}$:$\frac{7}{1}$=3:7=6:14,故X为C6H14,
A.相同条件下,C6H14的密度比水小,故A正确;
B.C6H14的同分异构体有己烷、2-甲基戊烷、3-甲基戊烷、2,3-二甲基丁烷、2,2-二甲基丁烷,故B错误;
C.X为烷烃,不能与溴发生加成反应使溴水褪色,故C错误;
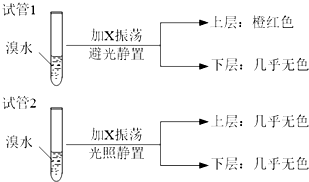
D.发生取代反应得到溴代烃,与水不互溶,可以可通过加水确定试管2中的有机层是上层还是下层,故D正确,
故选:BC.
点评 本题考查有机物推断,涉及烯烃、醇、羧酸等性质与转化,根据乙酸乙酯的结构进行分析,侧重考查学生分析推理能力,难度不大.


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:选择题
| A. | CO2溶于水形成碳酸,SiO2难溶于水 | |
| B. | CO2通入Na2SiO3稀溶液中,生成白色胶状沉淀硅酸 | |
| C. | 高温下SiO2与碳酸盐反应生成CO2 | |
| D. | HCl通入可溶性碳酸盐溶液中放出气体,氯化氢通入可溶性硅酸盐溶液中生成沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沱牌舍得酒标签注有“酒精度53%Vol”字样,它表示100g该白酒中含有53g,酒精 | |
| B. | 食盐可作调味剂,也可作食品防腐剂 | |
| C. | 碘是人体必须微量元素,所以要多吃富含高碘酸的食物 | |
| D. | “温室效应”、“酸雨”的形成都与氮氧化合物有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ③⑤ | C. | ①②③ | D. | ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50s的平均速率v(Cl2)=0.0016 mol•L-1•min-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol•L-1,则该反应的△H<0 | |
| C. | 温度为T时,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,反应达到平衡前v(正)>v(逆) | |
| D. | 温度为T时,起始时向容器中充入0.5 mol PCl3和0.5 mol Cl2,达到平衡时,PCl3的转化率小于80% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl CO2 Ne | B. | O2 KF SO2 | ||
| C. | HCl CH3CH2OH CH4 | D. | Na202 N2 H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2通入盐酸酸化的硝酸钡溶液 | B. | 在AlCl3溶液中滴入过量的氨水 | ||
| C. | 在空气中长期存放的漂白粉溶液 | D. | 将少量NaAlO2投入盐酸中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验步骤 | 实验结论 |
| ①氯水+1mLCCl4,振荡,静置,观察四氯化碳层颜色 | 氧化性从强到弱的顺序:氯、溴、碘 |
| ②NaBr溶液+氯水+1mLCCl4,振荡,静置,观察四氯化碳层颜色 | |
| ③KI溶液+氯水+1mLCCl4,振荡,静置,观察四氯化碳层颜色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com