
分析 (1)一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,含离子键的一定为离子化合物;
(2)①ⅡA族元素的价电子数为2,随核电荷数增大,价电子数不变;
②电子层结构相同,核电荷数越大,离子半径越小;电子层越多,离子半径越大;
③同周期主族元素,随原子序数递增原子半径减小;
(3)①当x-y=10时,可知质子数=核外电子数;
②当y=8时,若该微粒的氧化性很弱,得一个电子后变为原子,则原子的质子数为18+1=19;
(4)10电子微粒A、B反应得到两种10电子微粒,应是NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3+H2O(或HF+OH-═F-+H2O),以此来解答.
解答 解:(1)①O2只含共价键,为单质;
②SO2只含共价键,为共价化合物;
③CaCl2只含离子键,为离子化合物;
④HNO3只含共价键,为共价化合物;
⑤NaOH含离子键和共价键,为离子化合物;
⑥NH4Cl含离子键和共价键,为离子化合物,
属于共价化合物的是②④;属于离子化合物的是③⑤⑥;只含离子键的是③,
故答案为:②④;③⑤⑥;③;
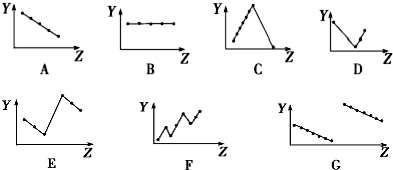
(2)①ⅡA族元素的价电子数为2,随核电荷数增大,价电子数不变,故图B符合,故答案为:B;
②电子层结构相同,核电荷数越大,离子半径越小,所以离子半径Na+>Mg2+>Al3+、P3->S2->Cl-,最外层电子数相同,电子层越多,离子半径越大,所以离子半径Cl->Na+.所以离子半径P3->S2->Cl->Na+>Mg2+>Al3+,故图E符合,故答案为:E;
③同周期主族元素,随原子序数递增原子半径减小,故图G符合,故答案为:G;
(3)①当x-y=10时,可知质子数=核外电子数,该微粒为原子,故答案为:原子;
②当y=8时,若该微粒的氧化性很弱,得一个电子后变为原子,则原子的质子数为18+1=19,该微粒为K+,故答案为:K+;
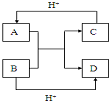
(4)10电子微粒A、B反应得到两种10电子微粒,应是NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3+H2O(或HF+OH-═F-+H2O),可推知A为NH4+,B为OH-,C为NH3,D为H2O(或A为HF,B为OH-,C为F-,D为H2O),
故答案为:HF(或NH4+);H2O.
点评 本题考查较综合,涉及无机物的推断、化学键、原子结构与元素周期律等,为高频考点,把握化学键的判断、离子之间的反应、元素周期律等为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

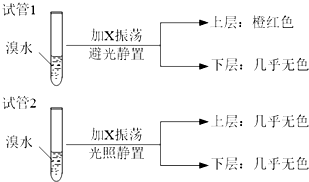
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 4:1 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲>乙>丙>丁 | B. | 乙>甲>丙>丁 | C. | 丁>丙>乙>甲 | D. | 乙>甲>丁>丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
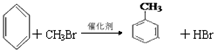 ;②C物质苯环上一卤代物只有两种.
;②C物质苯环上一卤代物只有两种.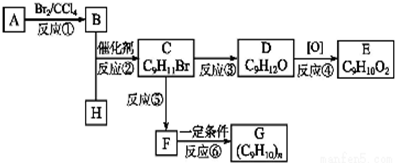
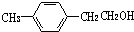 ,F的分子式C9H10.
,F的分子式C9H10.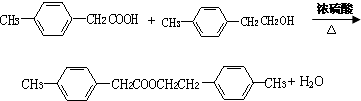 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com