
| A. | 1:1 | B. | 2:1 | C. | 4:1 | D. | 无法确定 |
分析 等物质的量的铝与稀硫酸和氢氧化钠反应放出气体的物质的量相等,而相同质量的、组成完全相同的某种由硅、铝、铁组成的合金粉末两份,一份投入到足量的稀硫酸中,另一份投入到足量的浓NaOH溶液中,结果在相同条件下收集到相同体积的气体,也就是铁与稀硫酸首产生的氢气与硅与氢氧化钠产生的氢气的物质的量相等,再结合转移电子数守恒分析解答.
解答 解:等物质的量的铝与稀硫酸和氢氧化钠反应放出气体的物质的量相等,而相同质量的、组成完全相同的某种由硅、铝、铁组成的合金粉末两份,一份投入到足量的稀硫酸中,另一份投入到足量的浓NaOH溶液中,结果在相同条件下收集到相同体积的气体,也就是铁与稀硫酸首产生的氢气与硅与氢氧化钠产生的氢气的物质的量相等,2Fe~~~2H2~~~Si,所以原合金中铁与硅的质量比是$\frac{2×56}{28}$=$\frac{4}{1}$,故选C.
点评 本题需要掌握化学方程式的计算格式和规范性,注意:相同质量的铝与硫酸或者氢氧化钠生成氢气的质量相等.


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ③⑤ | C. | ①②③ | D. | ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl CO2 Ne | B. | O2 KF SO2 | ||
| C. | HCl CH3CH2OH CH4 | D. | Na202 N2 H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2通入盐酸酸化的硝酸钡溶液 | B. | 在AlCl3溶液中滴入过量的氨水 | ||
| C. | 在空气中长期存放的漂白粉溶液 | D. | 将少量NaAlO2投入盐酸中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
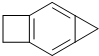 有机化合物的结构简式可进一步简化,如:
有机化合物的结构简式可进一步简化,如: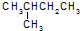 可简化为
可简化为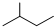 ,如图是一种形状酷似发射航天器的火箭的有机物分子(Rocketene),有关Rocketene的说法正确的是( )
,如图是一种形状酷似发射航天器的火箭的有机物分子(Rocketene),有关Rocketene的说法正确的是( )| A. | 该有机物属于烃的衍生物 | |
| B. | 该有机物属于苯的同系物 | |
| C. | Rocketene分子式为C9H8 | |
| D. | Rocketene与液溴用铁作催化剂反应生成的一溴代物有四种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
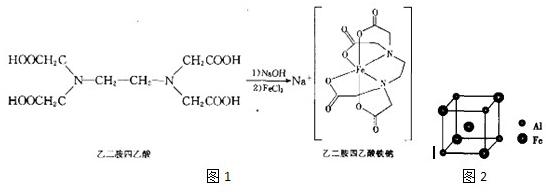
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com