
【题目】化合物![]() (
(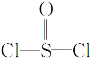 )是一种液态化合物,沸点77 ℃,在盛有
)是一种液态化合物,沸点77 ℃,在盛有![]() 水的锥形瓶中小心地滴加8~10滴
水的锥形瓶中小心地滴加8~10滴![]() ,可观察到反应剧烈,液面上有白雾形成,并逸出有气味的气体,该气体可使沾有品红试液的滤纸褪色。轻轻振荡锥形瓶,待白雾消失后往溶液中滴加
,可观察到反应剧烈,液面上有白雾形成,并逸出有气味的气体,该气体可使沾有品红试液的滤纸褪色。轻轻振荡锥形瓶,待白雾消失后往溶液中滴加![]() 溶液,有不溶于稀硝酸的白色沉淀析出。
溶液,有不溶于稀硝酸的白色沉淀析出。
(1)根据以上实验,写出![]() 与水反应的化学方程式:_____________________________________。
与水反应的化学方程式:_____________________________________。
(2)蒸干![]() 溶液得不到
溶液得不到![]() 固体,只能得到
固体,只能得到![]() ,所以工业上往往用
,所以工业上往往用![]() 和
和![]() 混合后共热来制取无水
混合后共热来制取无水![]() 。
。
①写出蒸干![]() 溶液过程中发生的化学反应方程式__________________________________________________。
溶液过程中发生的化学反应方程式__________________________________________________。
②写出该种制法可行性的原因:_______________________________________________,_______________________________________________________________________。(至少写出两个原因)。
【答案】![]()
![]()
![]() 与
与![]() 不反应且消耗水 生成
不反应且消耗水 生成![]() 抑制
抑制![]() 的水解
的水解
【解析】
(1)液面上有大量白雾,等白雾消失后,往溶液中滴加AgNO3溶液,有不溶于稀HNO3的凝乳状白色沉淀产生,说明白雾为盐酸的小液滴,即会产生HCl;同时有带刺激性气味的气体逸出,该气体可使滴有品红试液的滤纸褪色说明是SO2;
(2)①ZnCl2易水解生成Zn(OH)Cl和氯化氢,氯化氢易挥发,最终只能得到Zn(OH)Cl;
②用SOCl2与ZnCl33H2O混合共热,可得无水ZnCl2,是因SOCl2与水反应既可减少水的量,生成的HCl又抑制了ZnCl2的水解;
:(1)SOCl2是一种液态化合物,与水发生剧烈的非氧化还原反应,生成两种有刺激性气味的气体,该两种气体应该为氯化氢和二氧化硫,反应的方程式为SOCl2+H2O=2HCl↑+SO2↑,
故答案为:SOCl2+H2O=SO2↑+2HCl↑;
(2)①ZnCl2易水解生成Zn(OH)Cl和氯化氢,氯化氢易挥发,蒸干ZnCl2溶液反应为:![]() ,故答案为:
,故答案为:![]() ;
;
②SOCl2与水反应生成的氯化氢会对氯化锌水解起到抑制作用;反应的化学方程式为:SOCl2+H2O=2HCl↑+SO2↑,同时SOCl2与水反应消耗水,
故答案为:SOCl2与ZnCl2不反应且消耗水;生成HCl抑制ZnCl2水解;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】描述CH3—CH=CH—C≡C—CF3分子结构的下列叙述中,正确的是
A. 6个碳原子有可能都在一条直线上 B. 6个碳原子不可能都在一条直线上
C. 6个碳原子有可能都在同一平面上 D. 6个碳原子不可能都在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常情况下,NCl3是一种油状液体,其分子空间构型与NH3相似。下列对NCl3和NH3的有关叙述正确的是( )
A.NCl3的沸点高于NH3的沸点
B.在氨水中,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3H2O分子,则NH3H2O的结构式为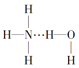
C.NCl3分子是非极性分子
D.NBr3比NCl3易挥发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A.图1表示0.001 mol·L一1盐酸滴定0.001 mol·L一1NaOH溶液的滴定曲线
B.图2所示,石墨的熔点比金刚石低
C.图3表示的是Al3+与OH一反应时含铝微粒浓度变化曲线,图中a区域的物质是Al(OH)3
D.图4所示,图中的阴影部分面积的含义是「v(正)一v(逆)〕
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,用浓度为
时,用浓度为![]() 的NaOH溶液滴定
的NaOH溶液滴定![]() 浓度均为
浓度均为![]() 的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是
的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是![]()

A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:![]()
B.用NaOH溶液滴定HY,当![]() 时溶液中
时溶液中![]()
C.用NaOH溶液滴定HY,当![]() 时溶液中
时溶液中![]()
D.当三种酸均滴定至![]() 时,HZ所用NaOH溶液体积最小
时,HZ所用NaOH溶液体积最小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿水青山就是金山銀山,生产生活中污染物的合理处理对环境保护具有重要意义。
(1)利用某些催化剂,成功实现将空气中的碳氧化合物和氮氧化合物转化为无毒的大气循环物质。
已知:①![]()
![]()
②NO(g)+CO(g)![]()
![]() N2(g)+CO2(g)
N2(g)+CO2(g)![]()
③2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g) ![]()
反应![]() 的
的![]() ________
________![]() ;某温度下,反应①②③的平衡常数分別カ
;某温度下,反应①②③的平衡常数分別カ![]() 、
、![]() 、
、![]() ,则该反应的K=________(用
,则该反应的K=________(用![]() 、
、![]() 、
、![]() 表示)。
表示)。
(2)温度为![]() ℃吋,在四个容积均为1L的恒容密闭容器中发生反应:
℃吋,在四个容积均为1L的恒容密闭容器中发生反应:
![]()
![]() ,测得有关实验数据如下:
,测得有关实验数据如下:
容器编号 | 物质的起始浓度( | 物质的平衡浓度( | |
|
|
| |
Ⅰ |
|
|
|
Ⅱ |
|
| |
Ⅲ |
|
| |
Ⅳ |
|
| |
①平衡时,容器Ⅱ与Ⅳ容器的总压强之比___________。
②温度不变,容器Ⅲ中达到平衡后再充入NO、![]() (g)各
(g)各![]() mol,则反应将向_____________。(填“正”或“逆”)方向进行。
mol,则反应将向_____________。(填“正”或“逆”)方向进行。
(3)常温下用0.100![]() 盐酸分别滴定10.00mL浓度均为0.100
盐酸分别滴定10.00mL浓度均为0.100![]() 的NaOH溶液和二甲胺[
的NaOH溶液和二甲胺[![]() ]溶液(在水中电离方式与氨相似),利电用传感器测得滴定过程中溶液的电导率如图所示。已知电解质溶液电导率越大导电能力越强。
]溶液(在水中电离方式与氨相似),利电用传感器测得滴定过程中溶液的电导率如图所示。已知电解质溶液电导率越大导电能力越强。

①a、b、c、d四点的水溶液中,由水电离出氢离子浓度大于![]()
![]() 的是________________,原因为_____________________。
的是________________,原因为_____________________。
②化学反应往往伴有热效应若为绝热体系a的温度______________(填“>”,“=”或“<”)c点的温度。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图所示,下列说法正确的是( )

A.化合物甲、乙均为手性分子
B.化合物甲中最多有8个原子共平面
C.化合物乙中采取sp3杂化的原子只有N、C
D.化合物甲的沸点明显高于化合物乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中实验操作、现象与结论对应关系正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 以酚酞为指示剂,用盐酸标准液滴定氢氧化钠溶液 | 溶液由红色变为浅红色便立刻读数 | 测得氢氧化钠溶液的浓度偏大 |
B | 用广泛pH试纸测定1mol/L NaHSO3 溶液的酸碱性 | 测得pH=3.2 | NaHSO3 溶液呈酸性,证明HSO3-的电离大于水解 |
C | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体 | 有白色沉淀生成,溶液红色变浅 | 证明纯碱溶液呈碱性是由CO32-水解引起的 |
D | 在0.1mol/LNa2S溶液中滴加少量等浓度的ZnSO4溶液,再加入少量等浓度的CuSO4溶液 | 先产生白色ZnS沉淀,后产生黑色CuS沉淀 | Ksp(ZnS)>Ksp(CuS) |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com