
【题目】下列有关三氧化硫的说法中,正确的是( )
A.三氧化硫极易溶于水,且与水反应生成H2SO3
B.SO3属于酸性氧化物
C.硫粉在过量的氧气中燃烧生成SO3
D.SO2、SO3均具有漂白性,能使紫色石蕊溶液褪色
科目:高中化学 来源: 题型:
【题目】有机物的结构可用“键线式”简化表示,如:CH3-CH=CH-CH3可表示为![]() ,有一种有机物X键线式为
,有一种有机物X键线式为![]() 下列关于有机物X的叙述错误的是
下列关于有机物X的叙述错误的是![]()
A. X的分子式为C8H8O3
B. 有机物Y足X的同分异构体,含有苯环、能与NaHC03溶液反应、且有三个取代基,则Y的结构有8种
C. X分子中的所有原子不可能在同一平面内
D. X能发生加成反应,取代反应,并能使溴水、酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯可用作有机溶剂溴苯是制备精细化工品的原料,也是制备农药的基本原料。其制备可采用下列装置:
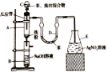
有关数据如下表:
密度(g·cm-3) | 熔点/℃ | 沸点/℃ | 溶解性 | |
溴 | 3.12 | -7.2 | 58.8 | 微溶于水,易溶于乙醇、乙醚、氯仿、四氯化碳等 |
苯 | 0.88 | 5.5 | 80.1 | 不溶于水,易溶于有机溶剂 |
溴苯 | 1.50 | -30.7 | 156.2 | 不溶于水,溶于甲醇、乙醚、苯、四氯化碳等多数有机溶剂 |
有关反应:
(ⅰ)![]() +Br2
+Br2![]()
![]() +HBr(溴苯制备反应)
+HBr(溴苯制备反应)
(ⅱ)![]() +H2O
+H2O![]() +HBr(反应微弱)
+HBr(反应微弱)
实验步骤:
在装置A底部放入少许石棉丝,然后加入2g铁粉;装置C中加入由22.0mL苯和10.0mL液溴混合而成的混合液;其他装置的试剂如图所示;打开装置 C的活塞,使苯、液溴混合液滴到铁粉上;取下装置B,进行下列流程图中的操作,最后得到11.1 mL溴苯。
粗溴苯与

回答下列问题:
(1)装置A中的铁粉可以用___________(填试剂的化学式)代替,原因是___________。
(2)装置B中的NaOH的作用是_____________________。
(3)装置D中苯的作用是___________。
(4)分离Ⅰ、分离Ⅱ、分离Ⅲ分别为___________(填标号)。
a.分液、蒸馏、过滤 b.分液、分液、过滤
c.过滤、分液、过滤 d.分液、过滤、过滤
(5)流程图中加入的CaCl2的作用是___________,若实验过程中省略该步操作,实验的产率_________(填“偏高”偏低“或“不变”)。
(6)本实验的产率为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在水溶液中能大量共存的是( )
A.Na+、Cl﹣、HCO3﹣、Ca2+
B.OH﹣、Na+、Mg2+、HCO3﹣
C.Na+、Cl﹣、H+、Ag+
D.Na+、SiO32﹣、H+、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某镍冶炼车间排放的漂洗废水中含有一定浓度的Ni2+和Cl-,图甲是双膜三室电沉积法回收废水中Ni2+的示意图,图乙描述的是实验中阴极液pH与镍回收率之间的关系。下列说法不正确的是

A. 交换膜b为阴离子交换膜
B. 阳极反应式为2H2O-4e-=O2↑+4H+
C. 阴极液pH= 1时,镍的回收率低主要是有较多H2生成
D. 浓缩室得到1L 0.5 mol/L盐酸时,阴极回收得到11.8 g镍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对反应X(g)+3Y(g)![]() 2Z(g)来说,下列反应速率最慢的是
2Z(g)来说,下列反应速率最慢的是
A. υ(X)=0.01mol/(L·s) B. υ(Z)=0.5 mol/(L·min)
C. υ(Y)=0.6 mol/(L·min) D. υ(X)=0.3 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如下图所示:
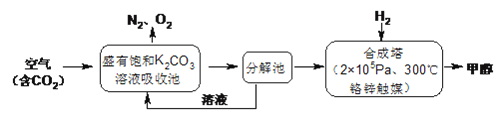
回答下列问题:
(1)进入分解池中主要物质是______;在合成塔中,若足量的H2与CO2反应,消耗4.4gCO2,生成气态的H2O和CH3OH,可放出5370J的热量,写出该反应的热化学方程式________。
(2)该工艺在哪些方面体现了“绿色自由”构想中的“绿色”: ①_______;②_______。
(3)一定条件下,往2L恒容密闭容器中充入1.0molCO2和3.0mol H2,在不同催化剂作用下,相同时间内CO2的转化率随温度变化如图所示:
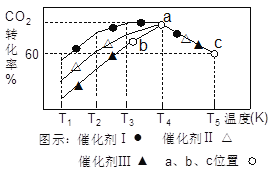
①催化剂效果最佳的是_______(填“催化剂I”.“催化剂Ⅱ”,“催化剂Ⅲ”)。b点v(正)______v(逆)(填“>”,“<”,“=”)。
②此反应在a点时已达平衡状态,a点的转化率比c点高的原因是_________。c点时该反应的平衡常数K=___________(保留一位小数)。
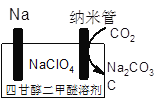
(4)科学家还研究了利用温室气体制造充电电池,下图为正在研究的Na—CO2可充电电池示意图,该装置放电时的总反应方程式为_________。
(5)己知25℃时H2CO3的电离平衡常数为:Kal =4.4×10-7、Ka2 =4.7×l0-ll,则反应:HCO3-+H2O![]() H2CO3+ OH-的平衡常数K=________。
H2CO3+ OH-的平衡常数K=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com