
����Ŀ�������ѧ���������ɫ���ɡ����롣�Ѻ��д���CO2�Ŀ�������K2CO3��Һ�У��ٰ�CO2����Һ����ȡ��������ʹ֮��H2��Ӧ���ɿ�������Դ�״����乤����������ͼ��ʾ��
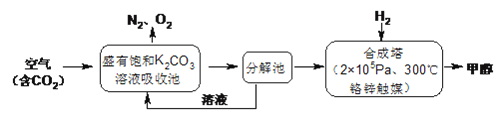
�ش��������⣺
(1)����ֽ������Ҫ������______���ںϳ����У���������H2��CO2��Ӧ������4.4gCO2��������̬��H2O��CH3OH���ɷų�5370J��������д���÷�Ӧ���Ȼ�ѧ����ʽ________��
(2)�ù�������Щ���������ˡ���ɫ���ɡ������еġ���ɫ���� ��_______����_______��
(3)һ�������£���2L�����ܱ������г���1.0molCO2��3.0mol H2���ڲ�ͬ���������£���ͬʱ����CO2��ת�������¶ȱ仯��ͼ��ʾ��
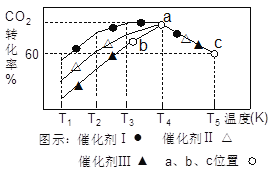
�ٴ���Ч����ѵ���_______�������I����������������������b��v������______v���棩���>������<������=������
�ڴ˷�Ӧ��a��ʱ�Ѵ�ƽ��״̬��a���ת���ʱ�c��ߵ�ԭ����_________��c��ʱ�÷�Ӧ��ƽ�ⳣ��K=___________(����һλС��)��
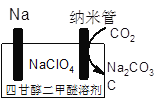
(4)��ѧ�һ��о����������������������أ���ͼΪ�����о���Na��CO2�ɳ����ʾ��ͼ����װ�÷ŵ�ʱ���ܷ�Ӧ����ʽΪ_________��
(5)��֪25��ʱH2CO3�ĵ���ƽ�ⳣ��Ϊ��Kal =4.4��10��7��Ka2 =4.7��l0��ll����Ӧ��HCO3��+H2O![]() H2CO3+ OH����ƽ�ⳣ��K=________��
H2CO3+ OH����ƽ�ⳣ��K=________��
���𰸡� KHCO3����̼����أ� CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g) ��H����53.7kJ/mol ���ٴ�����CO2�����������ԴCH3OH�� K2CO3��ѭ�����ã���������ѭ�����ã���̼���õ� ������ �� �÷�Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�������ƶ� K��2.1 4Na+3CO2==2Na2CO3+C K��2.3��10��8
H2O(g)+CH3OH(g) ��H����53.7kJ/mol ���ٴ�����CO2�����������ԴCH3OH�� K2CO3��ѭ�����ã���������ѭ�����ã���̼���õ� ������ �� �÷�Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�������ƶ� K��2.1 4Na+3CO2==2Na2CO3+C K��2.3��10��8
����������1������CO2�������Լ��Ȼ�ѧ��Ӧ����ʽ����д�����ճ��з���K2CO3��CO2��H2O=2KHCO3����˽���ֽ���е���Ҫ������KHCO3��H2��CO2��Ӧ�Ļ�ѧ����ʽΪ3H2��CO2=CH3OH��H2O������1molCO2���ų�������Ϊ5370��10��3/0.1kJ=53.70kJ�����Ȼ�ѧ����ʽΪ CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g) ��H����53.7kJ/mol ����2��������ɫ��ѧ��CO2��������ЧӦ���˷�Ӧ����CO2�����Լ��ٴ����е�CO2��CH3OHΪ�����Դ����3��������������ԭ������ѧƽ�ⳣ���ļ��㣬�ٸ���ͼ����I�Ĵ�Ч����ѣ�a��ת������ߣ�˵����ѧ��Ӧ�ﵽƽ�⣬b�㷴Ӧ������Ӧ������У���v��>v�棻�ڴ˷�Ӧ�Ƿ��ȷ�Ӧ���ﵽƽ��������¶ȵ����ߣ�ƽ�����淴Ӧ������У�CO2��ת���ʽ��ͣ�ԭ���Ǹ÷�Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���
H2O(g)+CH3OH(g) ��H����53.7kJ/mol ����2��������ɫ��ѧ��CO2��������ЧӦ���˷�Ӧ����CO2�����Լ��ٴ����е�CO2��CH3OHΪ�����Դ����3��������������ԭ������ѧƽ�ⳣ���ļ��㣬�ٸ���ͼ����I�Ĵ�Ч����ѣ�a��ת������ߣ�˵����ѧ��Ӧ�ﵽƽ�⣬b�㷴Ӧ������Ӧ������У���v��>v�棻�ڴ˷�Ӧ�Ƿ��ȷ�Ӧ���ﵽƽ��������¶ȵ����ߣ�ƽ�����淴Ӧ������У�CO2��ת���ʽ��ͣ�ԭ���Ǹ÷�Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���
CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g)
H2O(g)+CH3OH(g)
��ʼ�� 1 3 0 0
�仯�� 0.6 1.8 0.6 0.6
ƽ�⣺ 0.4 1.2 0.6 0.6 ���ݻ�ѧƽ�ⳣ���Ķ���K=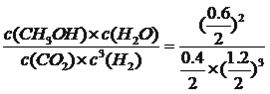 =2.1����4������缫��Ӧʽ����д������װ��ͼ��������ӦʽΪNa��e��=Na����������ӦʽΪ3CO2��4e��=2CO32����C����ʽ��ӵõ�4Na��3CO2=2Na2CO3��C����5������ƽ�ⳣ��������ƽ�ⳣ���Ķ��壬K=
=2.1����4������缫��Ӧʽ����д������װ��ͼ��������ӦʽΪNa��e��=Na����������ӦʽΪ3CO2��4e��=2CO32����C����ʽ��ӵõ�4Na��3CO2=2Na2CO3��C����5������ƽ�ⳣ��������ƽ�ⳣ���Ķ��壬K=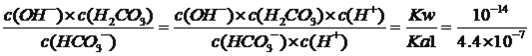 =2.3��10��8��
=2.3��10��8��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����������˵���У���ȷ���ǣ� ��
A.��������������ˮ������ˮ��Ӧ����H2SO3
B.SO3��������������
C.����ڹ�����������ȼ������SO3
D.SO2��SO3������Ư���ԣ���ʹ��ɫʯ����Һ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Fe��CO��Ni��Ϊ�ڢ���Ԫ�أ����ǵĻ��������������������Ź㷺��Ӧ�á�
��1����̬COԭ�ӵļ۵����Ų�ʽΪ____________��Co3+����3d�ܼ�����_________�ԳɶԵ��ӡ�
��2��Co3+��һ��������[Co(N3)(NH3)5]2+�У�Co+ ����λ����______________��1mol �������������Ҽ�����ĿΪ_____________����λ��N3-����ԭ���ӻ�����Ϊ____________________��
��3��Co2+��ˮ��Һ����[Co(H2O)6]2+���ڡ���Co2+����Һ�м��������ˮ�����ɸ��ȶ���[Co(NH3)6]2+ ����ԭ����___________________��
��4��ij��ɫ�����У�Fe2+��Fe3+�ֱ�ռ�������廥�����ڵĶ��㣬���������ÿ�����Ͼ���һ��CN-��K+λ���������ijǡ��λ���ϡ��ݴ˿�֪�þ���Ļ�ѧʽΪ____________����������Fe2+�����������γɵĿռ乹����_____________________��
��5��NiO�ľ���ṹ��ͼ����ʾ�����������������A Ϊ(0,0,0)��BΪ(1,1,0)����C�����������Ϊ_______________��

��6��һ���¶��£�NiO��������Է��ط�ɢ���γɡ������Ӳ㡱��������ΪO2-�����õ������У�Ni2+������У���ͼ�ң�����֪O2-�İ뾶Ϊa pm��ÿƽ��������Ϸ�ɢ�ĸþ��������Ϊ__________g���ú�a��NA�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���X�Ľṹ��ʽ��ͼ��ʾ���������й�˵���в���ȷ���ǣ������� 
A.�ܷ����ӳɡ�ȡ����������Ӧ
B.1 mol������������7mol NaOH��Ӧ
C.1 mol������������6 mol H2��Ӧ
D.����FeCl3��Һ������ɫ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ӦN2+3H22NH3�������仯��ͼ��ʾ���÷�Ӧ���Ȼ�ѧ����ʽ�ǣ������� 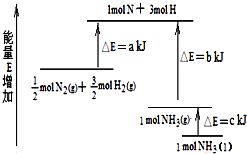
A.N2��g��+3H2��g��2NH3��l����H=2��a��b��c��kJ/mol
B.N2��g��+3H2��g��2NH3��g����H=2��b��a��kJ/mol
C.0.5N2��g��+1.5H2��g��NH3��l����H=��b+c��a��kJ/mol
D.0.5N2��g��+1.5H2��g��NH3��g����H=��a+b��kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������
�ٱ����ܶ�С��ˮ��Һ̬ˮ�к���(H2O)n���������������
�ڲ�ͬ��Ԫ����ɵĶ�ԭ�ӷ�����ļ�һ�����Ǽ��Լ�
�����Ӽ����������ӡ������ӵ������
���õ���ʽ��ʾMgCl2���γɹ��̣�![]()
��H2���Ӻ�Cl2���ӵķ�Ӧ���̾���H2��Cl2������Ĺ��ۼ�������������Hԭ�ӡ�Clԭ�ӣ�����Hԭ�ӡ�Clԭ���γ����Ӽ��Ĺ���
����˵����ȷ����( )
A. �٢ڢۢܢ� B. �٢� C. �� D. ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������������ء����������г������ʵ������뻯ѧʽ���Ӧ����
A.������ NaOHB.Ư���� NaClO
C.����ʯ�� CaCO3D.�ռ��� Na2CO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʵ���ҽ��ж��������Ʊ�������ʵ������װ�ã����̶ֹ�װ��δ�����������й�˵����ȷ����

A. �ر� K2���� K1���μ����ᣬ��װ�� B ��ÿ���� 1molNa2O2��ת�Ƶ�����ΪNA
B. �ر� K1���� K2���Լ� X ������ KMnO4 �� FeCl3 ��Һ������֤�� SO2 �л�ԭ��
C. Ϊ��ֹ������Ⱦ��װ��C��E�е��Լ���ȡ�ñ��͵�ʯ��ˮ
D. ʵ���������������������ԡ���ˮ�ԡ��ѻӷ��ԡ�ǿ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��W��X��Y��Z�����ڱ��е����λ����ͼ��ʾ������Z���������������������ڲ������������˵����ȷ����

A. �����ӵİ뾶:Z>Y>X
B. WX ��ZX�еĻ�ѧ��������ͬ
C. Ԫ�صķǽ�����:Y>X>W
D. Y���⻯���ˮ��Һ��ʹ��ɫʯ����ֽ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com