
【题目】Fe、CO、Ni均为第Ⅷ族元素,它们的化合物在生产生活中有着广泛的应用。
(1)基态CO原子的价电子排布式为____________,Co3+核外3d能级上有_________对成对电子。
(2)Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co+ 的配位数是______________,1mol 配离子中所含σ键的数目为_____________,配位体N3-中心原子杂化类型为____________________。
(3)Co2+在水溶液中以[Co(H2O)6]2+存在。向含Co2+的溶液中加入过量氨水可生成更稳定的[Co(NH3)6]2+ ,其原因是___________________。
(4)某蓝色晶体中,Fe2+、Fe3+分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个CN-,K+位于立方体的某恰当位置上。据此可知该晶体的化学式为____________,立方体中Fe2+间连接起来形成的空间构型是_____________________。
(5)NiO的晶体结构如图甲所示,其中离子坐标参数A 为(0,0,0),B为(1,1,0),则C离子坐标参数为_______________。

(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图乙),已知O2-的半径为a pm,每平方米面积上分散的该晶体的质量为__________g(用含a、NA的代数式表示)。
【答案】 3d74s2 1 6 23NA sp N元素电负性比O元素电负性小,N原子提供孤电子对的倾向更大,与Co2+形成的配位键更强 KFe2(CN)6 正四面体形 (1,1/2,1/2) ![]() (或
(或![]() )
)
【解析】(1)CO原子的核电荷数为27,基态CO的价电子排布式为3d74s2;Co3+核外电子排布为3d6,3d能级上有1对成对电子;正确答案:3d74s2 ; 1。
(2)氨气分子和N3-中氮原子中有孤电子对,能够与Co+形成配位键,共有5个氨分子和1个N3-离子,与Co+形成的的配位数为6;所以5 mol氨气分子提供σ键为15mol,1 mol N3-中含有σ键2 mol,形成配位键有6 mol,所以1mol 配离子中所含σ键的数目为23NA;杂化轨道数=中心原子的孤电子对数+中心原子的σ键的数目,所以N3-中心氮原子孤电子对数为0,σ键的数目为2,所以杂化轨道数为2,属于sp杂化;正确答案:6 ;23NA;sp。
(3)Co2+在水溶液中以[Co(H2O)6]2+存在。向含Co2+的溶液中加入过量氨水可生成更稳定的[Co(NH3)6]2+ ,其原因是N元素电负性比O元素电负性小,N原子提供孤电子对的倾向更大,与Co2+形成的配位键更强;正确答案:N元素电负性比O元素电负性小,N原子提供孤电子对的倾向更大,与Co2+形成的配位键更强。
(4)Fe2+、Fe3+占据立方体的互不相邻的顶点,则每个立方体上有4个Fe2+、4个Fe3+,根据晶体的空间结构特点,每个顶点上的粒子有1/8属于该立方体,则该立方体中有1/2个Fe2+、1/2个Fe3+,CN-位于立方体的棱上,棱上的微粒有1/4属于该立方体,该立方体中有3个CN-,所以该晶体的化学式为 [FeFe(CN)6]-,由于物质呈电中性,所以需要一个钾离子与之结合,所以该晶体的化学式为KFe2(CN)6;立方体中Fe2+间连接起来形成的空间构型是正四面体形;正确答案:KFe2(CN)6 ; 正四面体形。
(5)若NiO晶胞中离子坐标参数A为(0,0,0),B为(1,1,0),则由图可看出C离子坐标离x为1,离y为![]() ,离z为
,离z为![]() ,则坐标参数为(1,
,则坐标参数为(1,![]() ,
,![]() );正确答案:(1,1/2,1/2)。
);正确答案:(1,1/2,1/2)。
(6)根据结构知,氧离子和相邻的镍离子之间的距离为![]() a,距离最近的两个阳离子核间的距离是距离最近的氧离子和镍离子距离的
a,距离最近的两个阳离子核间的距离是距离最近的氧离子和镍离子距离的![]() 倍,所以其距离是2
倍,所以其距离是2![]() am;根据图片知,每个氧化镍所占的面积=2a m×2a m×sin60°×10-24,则每平方米含有的氧化镍个数=1/(2a m×2a m×sin60°×10-24)=
am;根据图片知,每个氧化镍所占的面积=2a m×2a m×sin60°×10-24,则每平方米含有的氧化镍个数=1/(2a m×2a m×sin60°×10-24)= ![]() ×1024;每个氧化镍的质量=
×1024;每个氧化镍的质量=![]() g,所以每平方米含有的氧化镍质量=
g,所以每平方米含有的氧化镍质量=![]() ×
×![]() ×1024=
×1024=![]() ;正确答案:
;正确答案:![]() (或
(或![]() )。
)。


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】溴苯可用作有机溶剂溴苯是制备精细化工品的原料,也是制备农药的基本原料。其制备可采用下列装置:
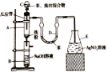
有关数据如下表:
密度(g·cm-3) | 熔点/℃ | 沸点/℃ | 溶解性 | |
溴 | 3.12 | -7.2 | 58.8 | 微溶于水,易溶于乙醇、乙醚、氯仿、四氯化碳等 |
苯 | 0.88 | 5.5 | 80.1 | 不溶于水,易溶于有机溶剂 |
溴苯 | 1.50 | -30.7 | 156.2 | 不溶于水,溶于甲醇、乙醚、苯、四氯化碳等多数有机溶剂 |
有关反应:
(ⅰ)![]() +Br2
+Br2![]()
![]() +HBr(溴苯制备反应)
+HBr(溴苯制备反应)
(ⅱ)![]() +H2O
+H2O![]() +HBr(反应微弱)
+HBr(反应微弱)
实验步骤:
在装置A底部放入少许石棉丝,然后加入2g铁粉;装置C中加入由22.0mL苯和10.0mL液溴混合而成的混合液;其他装置的试剂如图所示;打开装置 C的活塞,使苯、液溴混合液滴到铁粉上;取下装置B,进行下列流程图中的操作,最后得到11.1 mL溴苯。
粗溴苯与

回答下列问题:
(1)装置A中的铁粉可以用___________(填试剂的化学式)代替,原因是___________。
(2)装置B中的NaOH的作用是_____________________。
(3)装置D中苯的作用是___________。
(4)分离Ⅰ、分离Ⅱ、分离Ⅲ分别为___________(填标号)。
a.分液、蒸馏、过滤 b.分液、分液、过滤
c.过滤、分液、过滤 d.分液、过滤、过滤
(5)流程图中加入的CaCl2的作用是___________,若实验过程中省略该步操作,实验的产率_________(填“偏高”偏低“或“不变”)。
(6)本实验的产率为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对反应X(g)+3Y(g)![]() 2Z(g)来说,下列反应速率最慢的是
2Z(g)来说,下列反应速率最慢的是
A. υ(X)=0.01mol/(L·s) B. υ(Z)=0.5 mol/(L·min)
C. υ(Y)=0.6 mol/(L·min) D. υ(X)=0.3 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤,②加 过量NaOH溶液,③加适量盐酸,④加过量Na2CO3溶液,⑤加过量BaCl2溶液。正确的操作顺序是( )
A.②①④⑤③B.④②⑤①③C.②⑤④①③D.⑤②①④③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脱落酸是一种抑制生长的植物激素,因能促使叶子脱落而得名,其结构简式如下图所示,则有关脱落酸的说法中正确的是
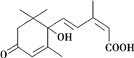
A. 脱落酸的分子式为C15H18O4
B. 脱落酸只能和醇类发生酯化反应
C. 1 mol 脱落酸最多可以和2 mol 金属钠发生反应
D. 1 mol脱落酸最多可以和2 mol 氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一碳化学是指以分子中只含一个碳原子的化合物(如一氧化碳、二氧化碳、甲烷、甲醇等)为原料,用化工的方法制造产品的化学体系的总称。我国能源比较丰富,煤的探明储量6000亿吨,居世界第三位,因此,发展一碳化学有着优越的条件和光明的前途。请回答下列有关问题。
(1)已知在一定温度下有如下反应:
I.C(s)+CO2(g)![]() 2CO(g)H1=akJ/mol
2CO(g)H1=akJ/mol
II.CO(g)+H2O(g)![]() H2(g)+CO2(g)△H2=bkJ/mol
H2(g)+CO2(g)△H2=bkJ/mol
III.C(s)+H2O(g)![]() CO(g)+H2(g)△H3________。
CO(g)+H2(g)△H3________。
(2)在一恒容的密闭容器中,加入lmolCO(g)、2molH2O(g),发生反应CO(g)+H2O(g)![]() H2(g)+CO2(g) △H ,CO的平衡转化率随温度的变化如图所示:
H2(g)+CO2(g) △H ,CO的平衡转化率随温度的变化如图所示:

①该反应的△H__0(填“<”或“>”。)
②在某温度下,能判断该反应是否达到化学平衡状态的依据是________。
a.混合气体中c(CO)不变 b.c(CO)=c(CO2)
c.υ正(H2O)=υ逆(H2) d.混合气体的平均相对分子质量不变
③A点时H2O(g)的转化率为__________。
④在体积不变时,要增大该反应的正反应速率可采取的措施是_______(写两条)。
⑤A点时该反应的平衡常数为________(保留到小数点后两位)。
⑥若在该容器中充入2molCO和3mol水蒸气进行反应,达到平衡时水蒸气的体积分数与H2的体积分数相等,则平衡后CO的体积分数为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如下图所示:
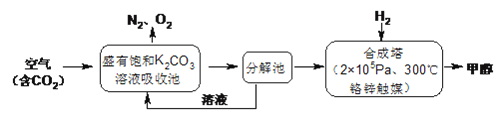
回答下列问题:
(1)进入分解池中主要物质是______;在合成塔中,若足量的H2与CO2反应,消耗4.4gCO2,生成气态的H2O和CH3OH,可放出5370J的热量,写出该反应的热化学方程式________。
(2)该工艺在哪些方面体现了“绿色自由”构想中的“绿色”: ①_______;②_______。
(3)一定条件下,往2L恒容密闭容器中充入1.0molCO2和3.0mol H2,在不同催化剂作用下,相同时间内CO2的转化率随温度变化如图所示:
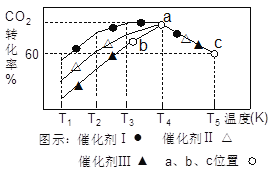
①催化剂效果最佳的是_______(填“催化剂I”.“催化剂Ⅱ”,“催化剂Ⅲ”)。b点v(正)______v(逆)(填“>”,“<”,“=”)。
②此反应在a点时已达平衡状态,a点的转化率比c点高的原因是_________。c点时该反应的平衡常数K=___________(保留一位小数)。
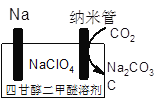
(4)科学家还研究了利用温室气体制造充电电池,下图为正在研究的Na—CO2可充电电池示意图,该装置放电时的总反应方程式为_________。
(5)己知25℃时H2CO3的电离平衡常数为:Kal =4.4×10-7、Ka2 =4.7×l0-ll,则反应:HCO3-+H2O![]() H2CO3+ OH-的平衡常数K=________。
H2CO3+ OH-的平衡常数K=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com