
【题目】一碳化学是指以分子中只含一个碳原子的化合物(如一氧化碳、二氧化碳、甲烷、甲醇等)为原料,用化工的方法制造产品的化学体系的总称。我国能源比较丰富,煤的探明储量6000亿吨,居世界第三位,因此,发展一碳化学有着优越的条件和光明的前途。请回答下列有关问题。
(1)已知在一定温度下有如下反应:
I.C(s)+CO2(g)![]() 2CO(g)H1=akJ/mol
2CO(g)H1=akJ/mol
II.CO(g)+H2O(g)![]() H2(g)+CO2(g)△H2=bkJ/mol
H2(g)+CO2(g)△H2=bkJ/mol
III.C(s)+H2O(g)![]() CO(g)+H2(g)△H3________。
CO(g)+H2(g)△H3________。
(2)在一恒容的密闭容器中,加入lmolCO(g)、2molH2O(g),发生反应CO(g)+H2O(g)![]() H2(g)+CO2(g) △H ,CO的平衡转化率随温度的变化如图所示:
H2(g)+CO2(g) △H ,CO的平衡转化率随温度的变化如图所示:

①该反应的△H__0(填“<”或“>”。)
②在某温度下,能判断该反应是否达到化学平衡状态的依据是________。
a.混合气体中c(CO)不变 b.c(CO)=c(CO2)
c.υ正(H2O)=υ逆(H2) d.混合气体的平均相对分子质量不变
③A点时H2O(g)的转化率为__________。
④在体积不变时,要增大该反应的正反应速率可采取的措施是_______(写两条)。
⑤A点时该反应的平衡常数为________(保留到小数点后两位)。
⑥若在该容器中充入2molCO和3mol水蒸气进行反应,达到平衡时水蒸气的体积分数与H2的体积分数相等,则平衡后CO的体积分数为_______。
【答案】 (a+b)kJ/mol < ac 20% 升高温度、使用催化剂、充入CO或H2O 0.17 10%
【解析】(1)应用盖斯定律作答。
(2)①根据图像,升高温度,CO的平衡转化率减小,平衡向逆反应方向移动,ΔH![]() 0。
0。
②根据化学平衡的特征和本质判断。
③根据图像计算转化CO物质的量,结合方程式计算转化H2O(g)的物质的量,进一步计算α(H2O)。
④根据浓度、压强、温度、催化剂等外界条件对化学反应速率的影响规律作答。
⑤用三段式计算A点时反应的平衡常数。
⑥用三段式计算平衡时CO的体积分数。
(1)应用盖斯定律,将I+II得,C(s)+H2O(g)![]() CO(g)+H2(g)ΔH3=ΔH1+ΔH2=(a+b)kJ/mol。
CO(g)+H2(g)ΔH3=ΔH1+ΔH2=(a+b)kJ/mol。
(2)①根据图像,升高温度,CO的平衡转化率减小,平衡向逆反应方向移动,ΔH![]() 0。
0。
②a项,混合气体中c(CO)不变说明反应达到平衡状态;b项,达到平衡时各组分的浓度保持不变,但不一定相等,c(CO)=c(CO2)不能说明反应达到平衡状态;c项,υ正(H2O)=υ逆(H2)说明反应达到平衡状态;d项,根据质量守恒定律,混合气体的总质量始终不变,该反应反应前后气体分子数不变,混合气体分子总物质的量始终不变,混合气体的平均相对分子质量始终不变,混合气体的平均相对分子质量不变不能说明反应达到平衡状态;能说明反应达到平衡状态的是a、c,答案选ac。
③根据图像A点时CO的平衡转化率为40%,转化CO物质的量为1mol![]() 40%=0.4mol,根据转化物质的量之比等于化学计量数之比,结合方程式CO(g)+H2O(g)
40%=0.4mol,根据转化物质的量之比等于化学计量数之比,结合方程式CO(g)+H2O(g)![]() H2(g)+CO2(g),转化H2O(g)物质的量为0.4mol,A点时H2O(g)的转化率为
H2(g)+CO2(g),转化H2O(g)物质的量为0.4mol,A点时H2O(g)的转化率为![]() 100%=20%。
100%=20%。
④在体积不变时,要增大该反应的正反应速率可采取的措施是:升高温度(升高温度加快反应速率)、使用催化剂(使用催化剂加快反应速率)、充入CO或H2O(g)(增大反应物浓度加快反应速率)。
⑤A点CO的平衡转化率为40%,用三段式
CO(g)+H2O(g)![]() H2(g)+CO2(g)
H2(g)+CO2(g)
n(起始)(mol) 1 2 0 0
n(转化)(mol)1![]() 40%=0.4 0.4 0.4 0.4
40%=0.4 0.4 0.4 0.4
n(平衡)(mol) 0.6 1.6 0.4 0.4
设容器的容积为VL,A点时该反应的平衡常数=![]() =
=![]() =0.17。
=0.17。
⑥设转化CO物质的量为xmol,用三段式
CO(g)+H2O(g)![]() H2(g)+CO2(g)
H2(g)+CO2(g)
n(起始)(mol) 2 3 0 0
n(转化)(mol) x x x x
n(平衡)(mol) 2-x 3-x x x
平衡时水蒸气的体积分数与H2的体积分数相等,平衡时H2O(g)和H2物质的量相等,即3-x=x,解得x=1.5,平衡时CO的物质的量为2mol-1.5mol=0.5mol,平衡时混合气体总物质的量为5mol,平衡后CO的体积分数等于CO物质的量分数=![]() 100%=10%。
100%=10%。


 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案科目:高中化学 来源: 题型:
【题目】Fe、CO、Ni均为第Ⅷ族元素,它们的化合物在生产生活中有着广泛的应用。
(1)基态CO原子的价电子排布式为____________,Co3+核外3d能级上有_________对成对电子。
(2)Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co+ 的配位数是______________,1mol 配离子中所含σ键的数目为_____________,配位体N3-中心原子杂化类型为____________________。
(3)Co2+在水溶液中以[Co(H2O)6]2+存在。向含Co2+的溶液中加入过量氨水可生成更稳定的[Co(NH3)6]2+ ,其原因是___________________。
(4)某蓝色晶体中,Fe2+、Fe3+分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个CN-,K+位于立方体的某恰当位置上。据此可知该晶体的化学式为____________,立方体中Fe2+间连接起来形成的空间构型是_____________________。
(5)NiO的晶体结构如图甲所示,其中离子坐标参数A 为(0,0,0),B为(1,1,0),则C离子坐标参数为_______________。

(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图乙),已知O2-的半径为a pm,每平方米面积上分散的该晶体的质量为__________g(用含a、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年,联合国把世界水日的主题定为“废水”,关注重点是寻找各种方式来减少和再利用废水。下列有关水资源的说法错误的是
A. 水是生命之源
B. 水体污染与人类活动无关
C. 合理开发利用,重在节约保护
D. 地球上可以利用的淡水资源有限
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物X的结构简式如图所示,则下列有关说法中不正确的是( ) 
A.能发生加成、取代、氧化反应
B.1 mol该物质最多可与7mol NaOH反应
C.1 mol该物质最多可与6 mol H2反应
D.能与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应N2+3H22NH3的能量变化如图所示,该反应的热化学方程式是( ) 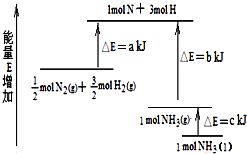
A.N2(g)+3H2(g)2NH3(l)△H=2(a﹣b﹣c)kJ/mol
B.N2(g)+3H2(g)2NH3(g)△H=2(b﹣a)kJ/mol
C.0.5N2(g)+1.5H2(g)NH3(l)△H=(b+c﹣a)kJ/mol
D.0.5N2(g)+1.5H2(g)NH3(g)△H=(a+b)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列生活中常见物质的俗名与化学式相对应的是
A.纯碱— NaOHB.漂白粉— NaClO
C.大理石— CaCO3D.烧碱— Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氧磷(POCl2)是重要的基础化工原料,广泛用于制药、染化。塑胶助剂等行业。某兴趣小组模拟PCl3直接氧化法制备POCl3,实验装置设计如下:
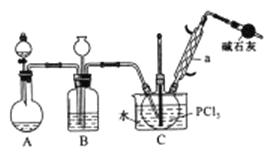
有关物质的部分性质如下表:
熔点/℃ | 沸点/℃ | 其他 | |
PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl,能溶于PCl3 |
回答下列问题:
(1)装置A中发生反应的化学方程式为___________________________。
(2)B装置的作用除观察O2的流速之外。还有__________________________。
(3)C装置控制反应在60℃~65℃进行,其主要目的是_______________________。
(4)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
Ⅰ.取xg 产品于锥形瓶中,加入足量NaOH 溶液,待完全反应后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000mol/L 的AgNO3容液40.00mL,使Cl-完全沉淀。
Ⅲ.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
Ⅳ.加入指示剂,用cmol/LNH4SCN 溶液滴定过量Ag+至终点,记下所用 体积VmL。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是________________(填标号)。
a.FeCl2 b.NH4Fe(SO4)2 c.淀粉 d.甲基橙
②Cl元素的质量百分含量为(列出算式)____________________。
③步骤Ⅲ加入硝基苯的目的是_________________,如无此操作,所测Cl元素含量将会____________填“偏大”“ 偏小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com