
【题目】短周期元素W、X、Y、Z在周期表中的相对位置如图所示,其中Z的最外层电子数等于其最内层电子数。下列说法正确的是

A. 简单离子的半径:Z>Y>X
B. WX 与ZX中的化学键类型相同
C. 元素的非金属性:Y>X>W
D. Y的氢化物的水溶液可使红色石蕊试纸变蓝
 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
【题目】近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如下图所示:
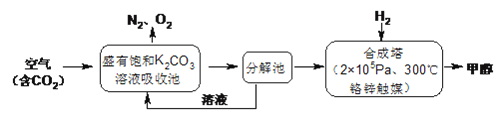
回答下列问题:
(1)进入分解池中主要物质是______;在合成塔中,若足量的H2与CO2反应,消耗4.4gCO2,生成气态的H2O和CH3OH,可放出5370J的热量,写出该反应的热化学方程式________。
(2)该工艺在哪些方面体现了“绿色自由”构想中的“绿色”: ①_______;②_______。
(3)一定条件下,往2L恒容密闭容器中充入1.0molCO2和3.0mol H2,在不同催化剂作用下,相同时间内CO2的转化率随温度变化如图所示:
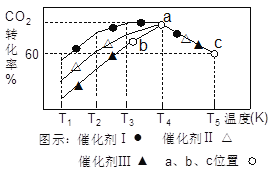
①催化剂效果最佳的是_______(填“催化剂I”.“催化剂Ⅱ”,“催化剂Ⅲ”)。b点v(正)______v(逆)(填“>”,“<”,“=”)。
②此反应在a点时已达平衡状态,a点的转化率比c点高的原因是_________。c点时该反应的平衡常数K=___________(保留一位小数)。
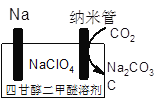
(4)科学家还研究了利用温室气体制造充电电池,下图为正在研究的Na—CO2可充电电池示意图,该装置放电时的总反应方程式为_________。
(5)己知25℃时H2CO3的电离平衡常数为:Kal =4.4×10-7、Ka2 =4.7×l0-ll,则反应:HCO3-+H2O![]() H2CO3+ OH-的平衡常数K=________。
H2CO3+ OH-的平衡常数K=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从冬青中提取出的有机物A可用合合成抗结肠炎药物Y及其他化学品,合成路线如图:
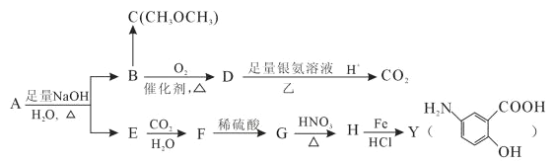
根据上述信息回答:
(1)请写出Y中含氧官能团的名称_________________________。
(2)写出反应③的反应类型:________________________________。
(3)写出反应①的化学方程式:_______________________________________。
(4)A的同分异构体I和J是重要的医药中间体,在浓硫酸的作用下I和J分别生成![]() 和
和![]() ,鉴别I和J的试剂为____________________。
,鉴别I和J的试剂为____________________。
(5)G的同分异构体中,满足下列条件的有_____________种。
①能发生银镜反应 ②能与氯化铁溶液发生显色反应
其中核磁共振氢谱显示四种不同类型的吸收峰。且其峰面积之比为1:2:2:1的结构简 式为____(写一种)。
(6)A的另一种同分异构体K用于合成高分子材料M(![]() ),K 可由L(
),K 可由L(![]() )制得。请写出以L为原料制得M 的合成路线流程图( 无机试剂任用)。流程图示例如下:
)制得。请写出以L为原料制得M 的合成路线流程图( 无机试剂任用)。流程图示例如下:![]() ___________________________
___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有着广泛的应用。现将设计的原电池通过导线与下图中电解池相连,其中a为电解液,X和Y是两块电板板,则:

(1)若X和Y均为惰性电极,a为饱和NaCl溶液,则电解时检验Y电极反应产物的方法是________________________。
(2)若X、Y分别为石墨和铁,a仍为饱和的NaCl溶液,则电解过程中生成的白色固体物质的电解总反应方程式为:________________,将其露置在空气中可观察到的现象为______。
(3)若X和Y均为情性电板,a为一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1molCu(OH)2,恰好恢复电解前的浓度,则电解过程中转移的电子的物质的量为______。
(4)某同学为了使反应2HCl+2Ag=2AgC1+H2↑能在上述装置中进行,则电解液及电极分别为:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:

(1)写出⑥元素的名称:______________。
(2)在以上元素的原子中,原子半径最大的是___________________(填元素符号)。
(3)地壳中含量居于第二位的元素位于元素周期表中的第___________周期,第_________族。
(4)⑦元素的气态氢化物化学式为___________________。
(5)⑤元素的最高价氧化物对应的水化物化学式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池利用原电池的工作原理将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能:能有效提高能源利用率,具有广泛的应用前景。某种燃料电池的总反应式是:CH4+2O2+2OH-=CO32-+ 3H2O,装置如下图所示,该电池用金属铂片作电极在两极上分别通甲烷和氧气。请思考回答以下问题:
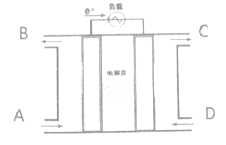
(1)电解质溶液可能是_________________;阳离子的移动方向:___________。(“左→右”、“右→左”)
(2)D气体通入的电池的_________极,发生的电极反应式:__________________;A通入的是______________,发生的电极反应式:_________________。
(3)当该电子流经导线的电子为4mol时,A入口至少需要通入_______L的气体(标准状态下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定的溶液中能大量共存的是 ( )
①无色溶液中:K+、Cu2+、Na+、SO42-
②pH=11的溶液中:K+、Ba2+、Cl-、HCO3-
③能使酚酞试剂变红的溶液中:Cl-、CO32-、NO3-、NH4+
A.①B.②
C.③D.全都不行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出氯原子的原子结构示意图____________,NH4Cl的电子式_______________;
(2)用电子式表示H2O的形成过程_________________________________________________;
(3)已知一定条件下,白磷转化为红磷释放出能量,则等质量的白磷比红磷具有的能量___(填“高”、“低”),故白磷比红磷稳定性_____(填“强”、“弱”),等质量的白磷和红磷充分燃烧均生成五氧化二磷,______放出热量多。
(4)在“绿色化学工艺”中,理想状态是反应物中的原子全部转化为欲制得的产物,即原子利用率为100%。下列反应类型能体现“原子经济性”原则的是 ____。(请填序号)
①置换反应,②化合反应, ③分解反应, ④取代反应, ⑤加成反应,⑥加聚反应
(5)电解法冶炼金属铝的化学方程式为_____________。取等物质的量的MgO和Fe2O3 的混合物进行铝热反应,反应的化学方程式为________________,引发铝热反应的实验操作是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com