
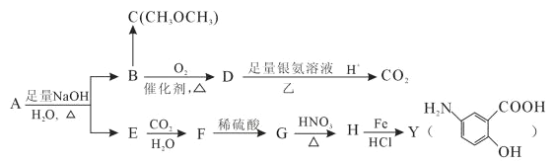
����Ŀ���Ӷ�������ȡ�����л���A���úϺϳɿ��᳦��ҩ��Y��������ѧƷ���ϳ�·����ͼ��
����������Ϣ�ش�
(1)��д��Y�к��������ŵ�����_________________________��
(2)д����Ӧ�۵ķ�Ӧ���ͣ�________________________________��
(3)д����Ӧ�ٵĻ�ѧ����ʽ��_______________________________________��
(4)A��ͬ���칹��I��J����Ҫ��ҽҩ�м��壬��Ũ�����������I��J�ֱ�����![]() ��
��![]() ������I��J���Լ�Ϊ____________________��
������I��J���Լ�Ϊ____________________��
(5)G��ͬ���칹���У�����������������_____________�֡�
���ܷ���������Ӧ �������Ȼ�����Һ������ɫ��Ӧ
���к˴Ź���������ʾ���ֲ�ͬ���͵����շ塣��������֮��Ϊ1:2:2:1�Ľṹ�� ʽΪ____(дһ��)��
(6)A����һ��ͬ���칹��K���ںϳɸ߷��Ӳ���M(![]() )��K ����L(
)��K ����L(![]() )�Ƶá���д����LΪԭ���Ƶ�M �ĺϳ�·������ͼ( ���Լ�����)������ͼʾ�����£�
)�Ƶá���д����LΪԭ���Ƶ�M �ĺϳ�·������ͼ( ���Լ�����)������ͼʾ�����£�![]() ___________________________
___________________________
���𰸡� �Ȼ������ӣ��ǻ� ȡ����Ӧ 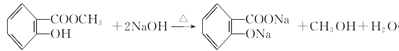 FeCl3��Һ����ˮ 9
FeCl3��Һ����ˮ 9 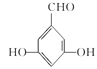 ��
�� ��
��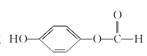 HOOC
HOOC![]() CH2Cl
CH2Cl![]() NaOOC
NaOOC![]() CH2OH
CH2OH![]() HOOC
HOOC![]() CH2OH
CH2OH![]()
![]()
��������������Ҫ�����л���Ľṹ�����ʡ�
(1)Y�к��������ŵ����ƣ��Ȼ����ǻ���
(2)��Ӧ����������Ӧ����Ӧ���ͣ�ȡ����Ӧ��
(3)B�Ǽ״�����Ӧ�ٷ������ڼ��������µ�ˮ�ⷴӦ����Ӧ�Ļ�ѧ����ʽ��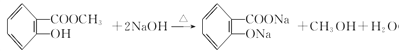 ��
��
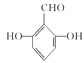
(4)I���д��ǻ���J���з��ǻ������÷��봼���ʵIJ����Լ���I��J�������Լ�ΪFeCl3��Һ����ˮ��
(5)G�����ǻ������ᡣ�ٱ�����G��ͬ���칹�庬��ȩ�����ڱ�����G��ͬ���칹�庬�з��ǻ������ڸ�G��ͬ���칹��������������Ϊ��OH����OH����CHOʱ����6�ֽṹ������������Ϊ��OH����OOCHʱ����3�ֽṹ����9�ֽṹ�����к˴Ź���������ʾ���ֲ�ͬ���͵����շ�����������֮��Ϊ1:2:2:1�Ľṹ��ʽΪ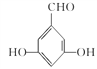 ��
��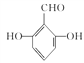 ��
�� ��
��
(6)��LΪԭ���Ƶ�M�ĺϳ�·������ͼ��HOOC![]() CH2Cl
CH2Cl![]() NaOOC
NaOOC![]() CH2OH
CH2OH![]() HOOC
HOOC![]() CH2OH
CH2OH![]()
![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���X�Ľṹ��ʽ��ͼ��ʾ���������й�˵���в���ȷ���ǣ������� 
A.�ܷ����ӳɡ�ȡ����������Ӧ
B.1 mol������������7mol NaOH��Ӧ
C.1 mol������������6 mol H2��Ӧ
D.����FeCl3��Һ������ɫ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʵ���ҽ��ж��������Ʊ�������ʵ������װ�ã����̶ֹ�װ��δ�����������й�˵����ȷ����

A. �ر� K2���� K1���μ����ᣬ��װ�� B ��ÿ���� 1molNa2O2��ת�Ƶ�����ΪNA
B. �ر� K1���� K2���Լ� X ������ KMnO4 �� FeCl3 ��Һ������֤�� SO2 �л�ԭ��
C. Ϊ��ֹ������Ⱦ��װ��C��E�е��Լ���ȡ�ñ��͵�ʯ��ˮ
D. ʵ���������������������ԡ���ˮ�ԡ��ѻӷ��ԡ�ǿ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����õ縺����ֵ����Ԥ��
A�����ӵļ��� B�����ӵĶԳ���
C�����ӵĿռ乹�� D����ѧ���ļ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
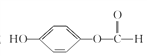
����Ŀ����������(POCl2)����Ҫ�Ļ�������ԭ�ϣ��㷺������ҩ��Ⱦ�����ܽ���������ҵ��ij��ȤС��ģ��PCl3ֱ���������Ʊ�POCl3��ʵ��װ��������£�
�й����ʵIJ����������±���
�۵�/�� | �е�/�� | ���� | |
PCl3 | -112 | 75.5 | ��ˮ����H3PO3��HCl����O2����POCl3 |
POCl3 | 2 | 105.3 | ��ˮ����H3PO4��HCl��������PCl3 |
�ش��������⣺
(1)װ��A�з�����Ӧ�Ļ�ѧ����ʽΪ___________________________��
(2)Bװ�õ����ó��۲�O2������֮�⡣����__________________________��
(3)Cװ�ÿ��Ʒ�Ӧ��60�桫65����У�����ҪĿ����_______________________��
(4)ͨ��������·����Բⶨ�������ײ�Ʒ��ClԪ�غ�����ʵ�鲽�����£�
��.ȡxg ��Ʒ����ƿ�У���������NaOH ��Һ������ȫ��Ӧ���ϡ���������ԡ�
��.����ƿ�м���0.1000mol/L ��AgNO3��Һ40.00mL��ʹCl-��ȫ������
��.�����м���2mL������������ҡ����ʹ�������汻�л��︲�ǡ�
��.����ָʾ������cmol/LNH4SCN ��Һ�ζ�����Ag+���յ㣬�������� ���VmL��
��֪��Ksp(AgCl)=3.2��10-10��Ksp(AgSCN)=2��10-12
�ٵζ�ѡ�õ�ָʾ����________________(����)��
a.FeCl2 b.NH4Fe(SO4)2 c.���� d.����
��ClԪ�ص������ٷֺ���Ϊ(�г���ʽ)____________________��
�۲���������������Ŀ����_________________�����˲���������ClԪ�غ�������____________�ƫ�� ƫС�����䡱)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���������ɫ���ɡ����룬�ѿ����е�CO2ת��Ϊ��������Դ�״���CH3OH�����÷�Ӧ���Ȼ�ѧ����ʽΪ��CO��g��+2H2��g����CH3OH��g��+H2O��g����H
��1������һ�����¶��ݵ������з���������Ӧ����Ӧ�ﵽƽ��ı�־�� ��
A.CO2��CH3OH��Ũ�����
B.H2�İٷֺ������ֲ���
C.������ѹǿ���ֲ���
D.3v����H2��=v����H2O��
E.�����л��������ܶȱ��ֲ���
��2������CO2��H2�Ļ������ֳ���ȷݣ������Ƿֱ�����¶Ȳ�ͬ���ݻ���ͬ�ĺ��������з���������Ӧ����Ӧ��ͬʱ���ü״���������� ��CH3OH���뷴Ӧ�¶�T�Ĺ�ϵ��ͼ1��������CO2ת��Ϊ�״��ķ�Ӧ�ġ�H0�������������������=���� 
��3��������Ӧ��ʵ�������в��õ��¶���300�棬��Ŀ���� ��
��4��300��ʱ����CO2��H2��1��3������ȳ���ij�ܱ������У�CO2��ƽ��ת���ʣ�a������ϵ��ѹǿ��P���Ĺ�ϵ��ͼ2��ʾ���ش����⣺ ���������������䣬��A������ѹ����ԭ����һ�룬һ��ʱ���Ӧ�ٴδﵽƽ�⣬��ԭƽ����Ƚ�����˵����ȷ���� ��
A.CO2��Ũ�ȼ�С
B.����Ӧ���������淴Ӧ���ʼ�С
C.CO2��H2���������Ȼ��1��3
D.H2�����������С��B��ƽ���������ƽ��Ħ������Ϊ��22.7g/mol��������һλС������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��W��X��Y��Z�����ڱ��е����λ����ͼ��ʾ������Z���������������������ڲ������������˵����ȷ����

A. �����ӵİ뾶:Z>Y>X
B. WX ��ZX�еĻ�ѧ��������ͬ
C. Ԫ�صķǽ�����:Y>X>W
D. Y���⻯���ˮ��Һ��ʹ��ɫʯ����ֽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO��CO2�ǻ�ʯȼ��ȼ�յ���Ҫ���
(1)����0.02mol CO2��0.01 mol CO�Ļ������ͨ��������Na2O2������ܱ������У�ͬʱ���ϵ��õ��ȼ����ַ�Ӧ������������_____g��
(2)��֪��2CO(g)+O2(g)==2CO2(g) ��H=-566.0kJ/mol������Eo-o=499.0kJ/mol����Ӧ:CO(g)+O2(g)![]() CO2(g)+O(g)�ġ�H=_________kJ/mol��
CO2(g)+O(g)�ġ�H=_________kJ/mol��
(3)��ij�ܱ������з�����Ӧ:2CO2(g)![]() 2CO(g)+O2(g)��1molCO2�ڲ�ͬ�¶��µ�ƽ��ֽ�����ͼ��ʾ��
2CO(g)+O2(g)��1molCO2�ڲ�ͬ�¶��µ�ƽ��ֽ�����ͼ��ʾ��

�ٺ��º���������,�ܱ�ʾ�ÿ��淴Ӧ�ﵽƽ��״̬����___(����ĸ)��
A.CO������������ֲ��� B.�����ڻ��������ܶȱ��ֲ���
C.�����ڻ�������ƽ��Ħ���������ֲ���
D.��λʱ���ڣ�����CO��Ũ�ȵ�������CO2��Ũ��
�ڷ�����ͼ����1500��ʱ��Ӧ�ﵽƽ��״̬�����������Ϊ1L�����ʱ��Ӧ��ƽ�ⳣ��K=___(����������1λС��)��
����2L�ĺ����ܱ������г���2molCO2(g)��������Ӧ: 2CO2(g)![]() 2CO(g)+O2(g)������¶�ΪT��ʱ��������O2�����ʵ���Ũ����ʱ��ı仯������II��ʾ��ͼ������I��ʾ���������II���ı�һ�ַ�Ӧ������c(O2)��ʱ��ı仯����ı��������____��a��b������COŨ�ȱ仯��ʾ�ľ���Ӧ���ʹ�ϵΪva(CO)____(�>����<����=��)vb(CO)��
2CO(g)+O2(g)������¶�ΪT��ʱ��������O2�����ʵ���Ũ����ʱ��ı仯������II��ʾ��ͼ������I��ʾ���������II���ı�һ�ַ�Ӧ������c(O2)��ʱ��ı仯����ı��������____��a��b������COŨ�ȱ仯��ʾ�ľ���Ӧ���ʹ�ϵΪva(CO)____(�>����<����=��)vb(CO)��
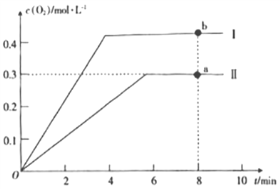
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʯȼ�Ͽ��ɡ��ӹ����̲�����H2S��������ͨ�����ַ�������������������ȡ������ͬʱ�������ʣ��������ֻ������ش��������⣺
(1)��֪��2H2(g)+O2(g)=2H2O(g) ��H1
S(s)+ O2(g)=SO2(g) ��H2
2S(s)![]() S2(g) ��H3
S2(g) ��H3
2H2S(g)+SO2(g)=3S(s)+2H2O(g) ��H4
��Ӧ2H2S(g)![]() 2H2(g)+ S2(g)�ġ�H=_____
2H2(g)+ S2(g)�ġ�H=_____
(2)��ҵ�ϲ��ݸ����ȷֽ�HzS�ķ�����ȡH2����Ĥ��Ӧ���з����H2��
�ں����ܱ������У���H2S����ʼŨ�Ⱦ�Ϊ0.009 mol/L���Ʋ�ͬ�¶Ƚ���H2S�ֽ⣺![]() ��ʵ������в��H2S��ת������ͼ��ʾ������a��ʾH2S��ƽ��ת�������¶ȵĹ�ϵ������b��ʾ��ͬ�¶�F��Ӧ������ͬʱ��ʱH2S��ת���ʡ�
��ʵ������в��H2S��ת������ͼ��ʾ������a��ʾH2S��ƽ��ת�������¶ȵĹ�ϵ������b��ʾ��ͬ�¶�F��Ӧ������ͬʱ��ʱH2S��ת���ʡ�

����935��ʱ���÷�Ӧ����t s H2S��ת���ʴﵽP����ֵ������ts����H2Ũ�ȱ仯��ʾ��ƽ����Ӧ����v(H2)=________��
���¶����ߣ�ƽ����____�����ƶ��������Ӧ�����淴Ӧ������ƽ�ⳣ��____���������С�����䡱����985��ʱ�÷�Ӧ��ƽ�ⳣ��Ϊ________��
������H2S�ֽ��¶ȵ����ߣ�����b��������a��������ԭ����___________��
(3)��ⷨ��������������FeCl3��Һ���պ�H2S�Ĺ�ҵ������������Һ�ö��Ե缫��⣬������������Һѭ�����á�

�ٽ�����ص���Һ�У�������____��
�������ĵ缫��ӦʽΪ________________��
�۵���ܷ�Ӧ�����ӷ���ʽ��____________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com