
| A、c(ClO-)=1.0mol?L-1的溶液中:Na+、SO32-、S2-、SO42- |
| B、由水电离的c(H+)=1×10-12 mol?L-1的溶液中:Ba2+、K+、Cl-、NO3- |
| C、常温下,c(H+)/c(OH-)=10-10的溶液中:Ca2+、Mg2+、HCO3-、I- |
| D、滴入少量KSCN溶液显红色的溶液中:Na+、K+、I-、SO42- |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
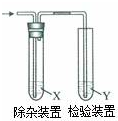 用如图所示装置检验乙烯时不需要除杂的是( )
用如图所示装置检验乙烯时不需要除杂的是( )| 乙烯的制备 | 试剂X | 试剂Y | |
| A | CH3CH2Br与NaOH溶液共热 | H2O | KMnO4酸性溶液 |
| B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
| C | CH3CH2OH与浓H2SO4共热至140℃ | NaOH溶液 | KMnO4酸性溶液 |
| D | CH3CH2OH与浓H2SO4共热至140℃ | NaOH溶液 | Br2的水溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Cu2+、NO3-、OH- |
| B、K+、Na+、Cl-、NO3- |
| C、Ag+、Na+、Cl-、K+ |
| D、Fe3+、K+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硫酸具有吸水性,可用于干燥氨气、二氧化碳等气体 |
| B、硝酸常用作金属铜加工前的酸洗 |
| C、碳酸钠可用于治疗胃酸过多 |
| D、三氧化二铁常用于生产红色油漆和涂料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图曲线a表示放热反应 X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关 系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
如图曲线a表示放热反应 X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关 系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )| A、升高温度 |
| B、加入催化剂 |
| C、缩小容器的容积 |
| D、增大容器的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba2+,Cl-,SO42-,K+ |
| B、K+,H+,CO32-,Na+ |
| C、Mg2+,Cl-,SO42-,K+ |
| D、Ag+,NO3-,Cl-,K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol Na2SO4溶于水中,所得溶液中Na+个数为NA |
| B、18g水含有电子数为8NA |
| C、标准状况下,22.4L氦气含有原子个数为NA |
| D、标准状况下,22.4 LH2O中含原子个数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com