
【题目】X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中,Z与Y相邻,Z与W也相邻;②Y、Z和W三种元素的原子最外层电子数之和为17。
请填空:
(1)Y、Z和W是否位于同一周期(填“是”或“否”):__________,理由是________________。
(2)Y是_______,Z是_______,W是_______。
(3)X、Y、Z和W可组成一种化合物,其原子个数比为8∶2∶4∶1,写出该化合物的名称及化学式: _______________。
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】模拟铁的电化学防护的实验装置如图所示,下列说法不正确的是
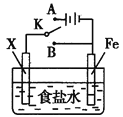
A.若X为碳棒,开关K置于A处可减缓铁的腐蚀
B.若X为锌棒,开关K置于A或B处均可减缓铁的腐蚀
C.若X为锌棒,开关K置于B处时,铁电极上发生的反应为2H++2e-=H2↑
D.若X为碳棒,开关K置于A处时,铁电极上发生的反应为2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学帮助水质检测站配制480 mL 0.5 mol·L-1NaOH溶液以备使用。
(1)该同学应选择________mL的容量瓶。使用容量瓶前必须进行的一步操作是______________
(2)其操作步骤如下图所示,则如图操作应在下图中的____________(填选项字母)之间。
A.②与③ B.①与② C.④与⑤
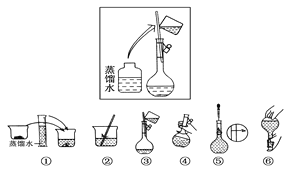
(3)该同学应称取NaOH固体________g
(4)下列操作对所配溶液的浓度大小有何影响?用“偏高”“偏低”或“无影响”填空:
①定容时俯视刻度线: ;
②摇匀后,液面低于刻度线,没有再加水: ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A. 氨气溶于醋酸溶液:NH3+H+→NH4+
B. 将硫化氢气体通入足量氢氧化钠溶液中,H2S+2OH-→S2-+2H2O
C. 向氯化亚铁溶液中加入溴水:Fe2++Br2→Fe3++2Br-
D. 碳酸氢钠溶液中加入足量的石灰水:2HCO3-+Ca2++2OH-→CaCO3↓+CO32-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl22H2O的流程如下:
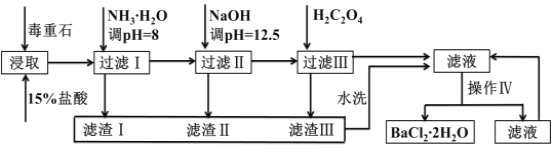
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀的pH | 11.9 | 9.1 | 1.9[ |
完全沉淀的pH | 13.9 | 11.1 | 3.2 |
已知:Ksp(BaC2O4)= 1.6×10–7,Ksp(CaC2O4)= 2.3×10–9
(1)实验室用37%的盐酸配制1mol/L盐酸,下列仪器中,不需要使用的是_______ __
a.容量瓶 b.量筒 c.烧杯 d.滴定管
为了加快毒重石的酸浸速率,可以采取的措施有______________(至少两条)。
(2)加入氨水调节溶液pH=8的目的是___________________________。滤渣Ⅱ中含________(填化学式)。加入H2C2O4时应避免过量,原因是___ __ ____________。
(3)操作Ⅳ的步骤是:______ ______、过滤。
(4)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42—+2H+=Cr2O72—+H2O ;Ba2++CrO42— =BaCrO4↓
步骤Ⅰ:移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0 mL。
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1 mL。
通过计算,氯化钡溶液浓度为___________mol·L-1(用含字母的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
下列叙述不正确的是
A.放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B.放电时阳极反应为: Fe(OH)3+5OH--3e-= FeO42-+4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.放电时的正极在充电时应接电源正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池反应的离子方程式为:Zn+2H+=Zn2++H2↑,则下列说法正确的是
A. HNO3可作电解质溶液 B. 电子从正极沿导线流向负极
C. 锌极质量不变 D. 石墨可作原电池的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与纯水的电离相似,液氨中也存在着微弱的电离:2NH3![]() NH4++NH2-.据此判断,以下叙述错误的是
NH4++NH2-.据此判断,以下叙述错误的是
A.液氨中含有NH3、NH4+、NH2-等粒子
B.一定温度下液氨中c(NH4+)·c(NH2-)是一个常数
C.液氨达到电离平衡时c(NH3)=c(NH4+)=c(NH2-)
D.只要不加入其他物质,液氨中c(NH4+)=c(NH2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒压的密闭容器中,充入 4L X和3L Y的混合气体,在一定条件下发生下列反应:4X(g)+3Y(g)![]() 2Q(g)+nR(g)达到平衡时测得 X的转化率为25%,此时混合气体的体积为6.5L。则该反应方程式中的n值是( )
2Q(g)+nR(g)达到平衡时测得 X的转化率为25%,此时混合气体的体积为6.5L。则该反应方程式中的n值是( )
A.3 B.5 C.6 D.8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com