
【题目】在恒温恒压的密闭容器中,充入 4L X和3L Y的混合气体,在一定条件下发生下列反应:4X(g)+3Y(g)![]() 2Q(g)+nR(g)达到平衡时测得 X的转化率为25%,此时混合气体的体积为6.5L。则该反应方程式中的n值是( )
2Q(g)+nR(g)达到平衡时测得 X的转化率为25%,此时混合气体的体积为6.5L。则该反应方程式中的n值是( )
A.3 B.5 C.6 D.8
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中,Z与Y相邻,Z与W也相邻;②Y、Z和W三种元素的原子最外层电子数之和为17。
请填空:
(1)Y、Z和W是否位于同一周期(填“是”或“否”):__________,理由是________________。
(2)Y是_______,Z是_______,W是_______。
(3)X、Y、Z和W可组成一种化合物,其原子个数比为8∶2∶4∶1,写出该化合物的名称及化学式: _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷及其化合物在生产、生活中有重要的用途。回答下列问题:
(1)在碱性条件下,次磷酸盐可用于化学镀银,完成其反应的离子方程式:
口H2PO2-+口Ag++口________=口PO43-+口Ag+口________
(2)由工业白磷(含少量砷、铁、镁等)制备高纯白磷(熔点44℃,沸点280℃),主要生产流程如下:
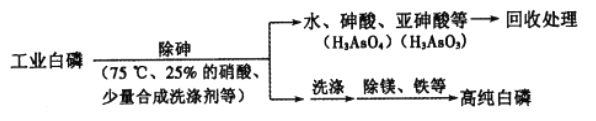
①关于除砷条件的说法合理的是__________(填字母)。
a.75℃使白磷熔化,并溶于水 b.硝酸浓度不易过大,防止白磷反应
c.温度不易过高,防止硝酸分解 d.适当提高温度,加快化学反应速率
②硝酸氧化除砷时被还原为NO,氧化相同质量的砷.当转化为亚砷酸的量越多,消耗硝酸的量越 _____________(填“多”或“少”)。
③某条件下,用一定量的硝酸处理一定量的工业白磷,砷的脱除率及磷的产率随硝酸质量分数的变化如右图,砷的脱除率从a点到b点降低的原因是_____________。

(3)某温度下,已知:
Ag+(aq)+2NH3(aq) ![]() Ag(NH3)2+(aq) k1=1.10×107
Ag(NH3)2+(aq) k1=1.10×107
AgCl(s)![]() Ag+(aq)+Cl-(aq) K2=1.45×10-10
Ag+(aq)+Cl-(aq) K2=1.45×10-10
①反应平衡常数的表达式K1=______________。
②计算可逆反应AgCl(s)+2NH3(aq)![]() Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=___________(保留2位有效数字)。
Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=___________(保留2位有效数字)。
③1Llmol/L氨水中最多可以溶解AgCl__________mol(保留1位有效数字,忽略溶液体积变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把80mL氢氧化钠溶液加入到120mL盐酸中,所得溶液的pH为2。如果混合前氢氧化钠溶液和盐酸的物质的量浓度相同,它们的浓度是 ( )
A.0.5mol/L B.0.1mol/L C.0.05mol/L D.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个体重50kg的健康人体内含铁元素2g,这2g铁元素以Fe2+和Fe3+的形式存在。Fe2+易被吸收,所以给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4)。服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收。请回答下列问题:
(1)以下为常见的铁元素的几种微粒,其中既有氧化性又有还原性的是____________。
A .Fe B.Fe2+ C.Fe3+
(2)维生素C可使食物中的Fe3+转化为Fe2+,在此过程中__________是氧化剂,说明维生素C具有 性。
(3)在人体中进行Fe2+![]() Fe3+的转化时,①反应中的Fe2+发生 反应,②反应中的Fe3+被_______________。
Fe3+的转化时,①反应中的Fe2+发生 反应,②反应中的Fe3+被_______________。
(4)市场上出售的某种麦片中含有微量的颗粒细小的还原性铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐。此反应的化学方程式为___________________________,离子方程式为_________________________。
(5)己知下列反应:
①H2O2+2Fe3+=2Fe2++O2↑+2H+②2Fe2++H2O2+2H+=2Fe3++2H2O
反应①中生成1 molO2转移电子的物质的量为__________,反应①、②的总反应方程式为______________________,
在该反应中Fe3+的作用为________________。
(6)在Fe+4HNO3=Fe(NO3)3+NO↑+2H2O的反应中, HNO3表现了___________性和_____________ 性,毎有1 molFe参加反应转移电子______________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中,一定要加入适当的还原剂才能实现的是( )
A.KMnO4→MnO2 B.HCl→Cl2
C.Fe2O3→Fe D.CaO→CaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《奔跑吧兄弟》是一档热播的娱乐节目,其中蕴含着许多化学知识,其中一期节目,队员用水枪将酚酞溶液喷射到对方的“名牌”上,立即变红色。事先浸泡“名牌”的溶液可能是()
A.白酒 B.纯碱溶液 C.食盐溶液 D.柠檬酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中氯离子浓度与50mL1mol·L-1的AlCl3溶液中氯离子浓度相等的是 ( )
A.150mL1mol·L-1的NaCl B.150mL3mol·L-1的KCl
C.75mL2 mol·L-1的CaCl2 D.75mL2mol·L-1的NH4Cl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com