
【题目】一个体重50kg的健康人体内含铁元素2g,这2g铁元素以Fe2+和Fe3+的形式存在。Fe2+易被吸收,所以给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4)。服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收。请回答下列问题:
(1)以下为常见的铁元素的几种微粒,其中既有氧化性又有还原性的是____________。
A .Fe B.Fe2+ C.Fe3+
(2)维生素C可使食物中的Fe3+转化为Fe2+,在此过程中__________是氧化剂,说明维生素C具有 性。
(3)在人体中进行Fe2+![]() Fe3+的转化时,①反应中的Fe2+发生 反应,②反应中的Fe3+被_______________。
Fe3+的转化时,①反应中的Fe2+发生 反应,②反应中的Fe3+被_______________。
(4)市场上出售的某种麦片中含有微量的颗粒细小的还原性铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐。此反应的化学方程式为___________________________,离子方程式为_________________________。
(5)己知下列反应:
①H2O2+2Fe3+=2Fe2++O2↑+2H+②2Fe2++H2O2+2H+=2Fe3++2H2O
反应①中生成1 molO2转移电子的物质的量为__________,反应①、②的总反应方程式为______________________,
在该反应中Fe3+的作用为________________。
(6)在Fe+4HNO3=Fe(NO3)3+NO↑+2H2O的反应中, HNO3表现了___________性和_____________ 性,毎有1 molFe参加反应转移电子______________mol。
【答案】(1)B;(2)Fe3+;还原;(3)氧化;还原
(4)Fe+2HCl==FeCl2+H2↑Fe+2H+==Fe2++H2↑
(5)2mol;2H2O2==2H2O+O2↑;催化剂;(6)酸;氧化;3
【解析】
试题分析:(1)元素具有变价时,最低价只有还原性,最高价只有氧化性,中间价态,具有两性;A.Fe只有还原性B.Fe2+既有氧化性,又有还原性;C.Fe3+只有氧化性;(2)Fe3+转化为Fe2+,Fe3+做氧化剂;维生素C具有还原性;(3)Fe2+→Fe3+发生氧化反应;Fe3+→Fe2+,Fe3+被还原;(4)胃液主要成分为盐酸,铁与盐酸反应:Fe+2HCl===FeCl2+H2↑;Fe+2H+===Fe2++H2↑;
(5)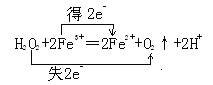 生成1molO2转移电子的物质的量2mol;①②两式相加,得2H2O2==2H2O+O2↑;Fe3+反应前后质量和性质保持不变,起作用催化剂;(6)在Fe+4HNO3=Fe(NO3)3+NO↑+2H2O的反应中,硝酸被还原,表现氧化性,生成硝酸盐,表现酸性;毎有1 molFe参加反应转移电子3mol。
生成1molO2转移电子的物质的量2mol;①②两式相加,得2H2O2==2H2O+O2↑;Fe3+反应前后质量和性质保持不变,起作用催化剂;(6)在Fe+4HNO3=Fe(NO3)3+NO↑+2H2O的反应中,硝酸被还原,表现氧化性,生成硝酸盐,表现酸性;毎有1 molFe参加反应转移电子3mol。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:
【题目】毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl22H2O的流程如下:
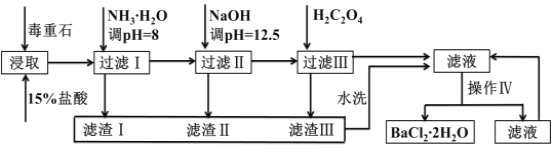
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀的pH | 11.9 | 9.1 | 1.9[ |
完全沉淀的pH | 13.9 | 11.1 | 3.2 |
已知:Ksp(BaC2O4)= 1.6×10–7,Ksp(CaC2O4)= 2.3×10–9
(1)实验室用37%的盐酸配制1mol/L盐酸,下列仪器中,不需要使用的是_______ __
a.容量瓶 b.量筒 c.烧杯 d.滴定管
为了加快毒重石的酸浸速率,可以采取的措施有______________(至少两条)。
(2)加入氨水调节溶液pH=8的目的是___________________________。滤渣Ⅱ中含________(填化学式)。加入H2C2O4时应避免过量,原因是___ __ ____________。
(3)操作Ⅳ的步骤是:______ ______、过滤。
(4)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42—+2H+=Cr2O72—+H2O ;Ba2++CrO42— =BaCrO4↓
步骤Ⅰ:移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0 mL。
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1 mL。
通过计算,氯化钡溶液浓度为___________mol·L-1(用含字母的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质属于常见氧化剂的一组是( )
A. Cl2、O2、FeCl3、KMnO4
B. O2、KMnO4、C、H2
C. Na、K、FeCl2、H2、CO
D. CuO、CO、Fe2O3、H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。
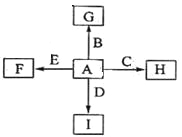
已知:
①反应![]() 能放出大量的热,该反应曾应用于铁轨的焊接;
能放出大量的热,该反应曾应用于铁轨的焊接;
②I是一种常见的温室气体,它和E可以发生反应:![]() ,F中E元素的质量分数为60%。
,F中E元素的质量分数为60%。
回答问题:
(1)①中反应的化学方程式为 ;
(2)化合物I的电子式为 ;
(3)C与过量NaOH溶液反应的离子方程式为 ,反应后溶于与过量化合物I反应的离子方程式为 ;
(4)E在I中燃烧观察到的现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒压的密闭容器中,充入 4L X和3L Y的混合气体,在一定条件下发生下列反应:4X(g)+3Y(g)![]() 2Q(g)+nR(g)达到平衡时测得 X的转化率为25%,此时混合气体的体积为6.5L。则该反应方程式中的n值是( )
2Q(g)+nR(g)达到平衡时测得 X的转化率为25%,此时混合气体的体积为6.5L。则该反应方程式中的n值是( )
A.3 B.5 C.6 D.8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol碳在氧气中完全燃烧生成气体,放出393kJ的热量,下列热化学方程式表示正确的是
A. C(s)+O2(g)→CO2(g)+393kJ
B. C + O2→ CO2+393kJ
C. C (s) + O2 (g)→CO2 (g)-393kJ
D. C (s) +1/2O2 (g) → CO(g) +393kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率是描述化学反应进行快慢程度的物理量。下面是某同学测定化学反应速率并探究其影响因素的实验。
Ⅰ.测定化学反应速率
该同学利用如图装置测定化学反应速率。(已知:S2O32-+2H+ = H2O+S↓+SO2↑)

(1) 为保证实验准确性、可靠性,利用该装置进行实验前应先进行的步骤是 ;除如图所示的实验用品、仪器外,还需要的一件实验仪器是______ 。
(2)若在2 min时收集到224 mL(已折算成标准状况)气体,可计算出该2 min内H+的反应速率,而该测定值比实际值偏小,其原因是 。
(3)试简述测定该反应的化学反应速率的其他方法(写一种):
Ⅱ.为探讨化学反应速率的影响因素,设计的实验方案如下表。
(已知 I2+2S2O32- = S4O62-+2I-,其中Na2S2O3溶液均足量)
实验序号 | 体积V/mL | 时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0[ | 4.0 | 0.0 | t1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
(4)该实验进行的目的是 ,表中Vx= mL,比较t1、t2、t3大小,试推测该实验结论:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. ![]() 的溶液中:Na+、K+、SiO32—、SO32-
的溶液中:Na+、K+、SiO32—、SO32-
B. pH=1的溶液中:K+、Al3+、SO42-、F—
C. 与镁反应生成氢气的溶液中:Na+、Ba2+、NO3-、Cl-
D. 0.1mol/L的NaHCO3溶液中:NH4+、Mg2+、Br-、AlO2-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com