
【题目】下图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。
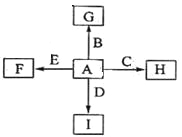
已知:
①反应![]() 能放出大量的热,该反应曾应用于铁轨的焊接;
能放出大量的热,该反应曾应用于铁轨的焊接;
②I是一种常见的温室气体,它和E可以发生反应:![]() ,F中E元素的质量分数为60%。
,F中E元素的质量分数为60%。
回答问题:
(1)①中反应的化学方程式为 ;
(2)化合物I的电子式为 ;
(3)C与过量NaOH溶液反应的离子方程式为 ,反应后溶于与过量化合物I反应的离子方程式为 ;
(4)E在I中燃烧观察到的现象是 。
【答案】(1)2Al+Fe2O3![]() Al2O3+2Fe(2)
Al2O3+2Fe(2)![]() 。
。
(3)2Al+2OH-+2H2O=2AlO2-+3H2↑,AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-。
(4)镁条剧烈燃烧,生成白色固体,同时集气瓶内壁上有黑色固体附着。
【解析】
试题分析:根据题给信息和转化关系推断,根据信息①推断,C为铝,B为铁,H为氧化铝,G为氧化铁;根据信息②:二氧化碳是温室气体,所以I是二氧化碳;二氧化氮和E反应发反应生成F,F中E元素的质量分数为60%,则E为镁,F为氧化镁,D为碳,A为氧气。
(1)①中反应的化学方程式为2Al+Fe2O3![]() Al2O3+2Fe。
Al2O3+2Fe。
(2)二氧化碳的电子式为![]() 。
。
(3)铝与过量NaOH溶液反应生成偏铝酸钠和氢气,离子方程式为2Al + 2OH- + 2H2O=2AlO2- + 3H2↑,偏铝酸钠溶液与过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,离子方程式为AlO2- + CO2 + 2H2O=Al(OH)3↓+ HCO3- 。
(4)镁在二氧化碳中燃烧观察到的现象是镁条剧烈燃烧,生成白色固体,同时集气瓶内壁上有黑色固体附着。


科目:高中化学 来源: 题型:
【题目】[有机化学基础]用乙烯、甲苯、E三种原料合成高分子药物M和有机中间体L的路线如下:
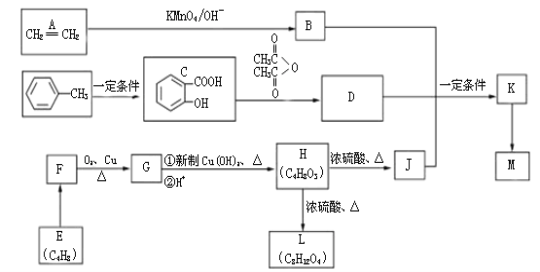
已知:

III .有机物L是一种六元环酯,M的分子式是(C15H16O6)n
(1)C中含氧官能团的名称____ ____,D的结构简式_______________。
(2)E在KMO4/OH- 中转化成F,F的结构简式_________________,H→J的反应类型______________。
(3)H→L的化学反应方程式是_________________________。
(4)K→M属于加聚反应,K的结构简式是____ ____。
(5)写出一定量的C与足量NaOH溶液反应的化学方程式 。
(6)写出一种符合下列条件的C的同分异构体的结构简式____ ___。
① 属于芳香族化合物;② 能发生银镜反应;③ 遇FeCl3溶液能发生显色反应;④ 核磁共振氢谱有4组峰,且峰面积之比为l:l:2:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列元素全部是微量元素的一组是
①K、S、Ca、Fe ②Mg、N、Mn、B ③Fe、Mn、B、Zn ④P、S、B、Mo
A. ① B. ② C. ③ D. ④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷及其化合物在生产、生活中有重要的用途。回答下列问题:
(1)在碱性条件下,次磷酸盐可用于化学镀银,完成其反应的离子方程式:
口H2PO2-+口Ag++口________=口PO43-+口Ag+口________
(2)由工业白磷(含少量砷、铁、镁等)制备高纯白磷(熔点44℃,沸点280℃),主要生产流程如下:
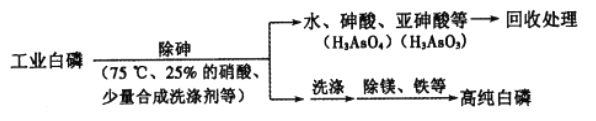
①关于除砷条件的说法合理的是__________(填字母)。
a.75℃使白磷熔化,并溶于水 b.硝酸浓度不易过大,防止白磷反应
c.温度不易过高,防止硝酸分解 d.适当提高温度,加快化学反应速率
②硝酸氧化除砷时被还原为NO,氧化相同质量的砷.当转化为亚砷酸的量越多,消耗硝酸的量越 _____________(填“多”或“少”)。
③某条件下,用一定量的硝酸处理一定量的工业白磷,砷的脱除率及磷的产率随硝酸质量分数的变化如右图,砷的脱除率从a点到b点降低的原因是_____________。

(3)某温度下,已知:
Ag+(aq)+2NH3(aq) ![]() Ag(NH3)2+(aq) k1=1.10×107
Ag(NH3)2+(aq) k1=1.10×107
AgCl(s)![]() Ag+(aq)+Cl-(aq) K2=1.45×10-10
Ag+(aq)+Cl-(aq) K2=1.45×10-10
①反应平衡常数的表达式K1=______________。
②计算可逆反应AgCl(s)+2NH3(aq)![]() Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=___________(保留2位有效数字)。
Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=___________(保留2位有效数字)。
③1Llmol/L氨水中最多可以溶解AgCl__________mol(保留1位有效数字,忽略溶液体积变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如图:

已知:
① 钴与盐酸反应的化学方程式为:Co+2HCl→CoCl2+H2↑
② CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110 ~120℃时,失去结晶水变成有毒的无水氯化钴。
③ 部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |
(1)在上述工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为_______________________。
(2)加入碳酸钠调节pH至a,a的范围是________________________。
(3)操作Ⅰ包含3个实验基本操作,它们依次是____________________和过滤。
(4)制得的CoCl2·6H2O在烘干时需减压烘干的原因是_____________________。
(5)为测定产品中CoCl2·6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量。通过计算发现产品中CoCl2·6H2O的质量分数大于100%,其原因可能是____________ ___。
(6)在实验室,为了从上述产品中获得纯净的CoCl2·6H2O,通常先将产品溶解在乙醚中,除去不溶性杂质后,再进行 _操作。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把80mL氢氧化钠溶液加入到120mL盐酸中,所得溶液的pH为2。如果混合前氢氧化钠溶液和盐酸的物质的量浓度相同,它们的浓度是 ( )
A.0.5mol/L B.0.1mol/L C.0.05mol/L D.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个体重50kg的健康人体内含铁元素2g,这2g铁元素以Fe2+和Fe3+的形式存在。Fe2+易被吸收,所以给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4)。服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收。请回答下列问题:
(1)以下为常见的铁元素的几种微粒,其中既有氧化性又有还原性的是____________。
A .Fe B.Fe2+ C.Fe3+
(2)维生素C可使食物中的Fe3+转化为Fe2+,在此过程中__________是氧化剂,说明维生素C具有 性。
(3)在人体中进行Fe2+![]() Fe3+的转化时,①反应中的Fe2+发生 反应,②反应中的Fe3+被_______________。
Fe3+的转化时,①反应中的Fe2+发生 反应,②反应中的Fe3+被_______________。
(4)市场上出售的某种麦片中含有微量的颗粒细小的还原性铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐。此反应的化学方程式为___________________________,离子方程式为_________________________。
(5)己知下列反应:
①H2O2+2Fe3+=2Fe2++O2↑+2H+②2Fe2++H2O2+2H+=2Fe3++2H2O
反应①中生成1 molO2转移电子的物质的量为__________,反应①、②的总反应方程式为______________________,
在该反应中Fe3+的作用为________________。
(6)在Fe+4HNO3=Fe(NO3)3+NO↑+2H2O的反应中, HNO3表现了___________性和_____________ 性,毎有1 molFe参加反应转移电子______________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中,一定要加入适当的还原剂才能实现的是( )
A.KMnO4→MnO2 B.HCl→Cl2
C.Fe2O3→Fe D.CaO→CaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,水既不是氧化剂,也不是还原剂的是
A.2Na+2H20=2Na0H+H2↑ B.C12+H20=HC1+HC10
C.2F2+2H20=4HF+02 D.2H20![]() 2H2↑+02↑
2H2↑+02↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com