
����Ŀ��[�л���ѧ����]����ϩ���ױ���E����ԭ�Ϻϳɸ߷���ҩ��M���л��м���L��·�����£�
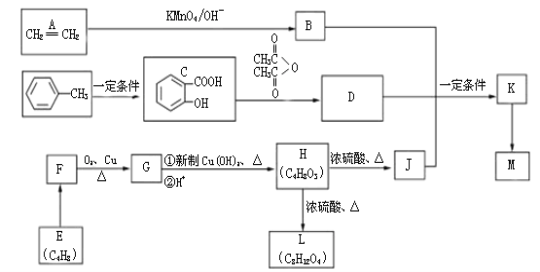
��֪��

III ���л���L��һ����Ԫ������M�ķ���ʽ��(C15H16O6)n
��1��C�к��������ŵ�����____ ____��D�Ľṹ��ʽ_______________��
��2��E��KMO4/OH- ��ת����F��F�Ľṹ��ʽ_________________,H��J�ķ�Ӧ����______________��
��3��H��L�Ļ�ѧ��Ӧ����ʽ��_________________________��
��4��K��M���ڼӾ۷�Ӧ��K�Ľṹ��ʽ��____ ____��
��5��д��һ������C������NaOH��Һ��Ӧ�Ļ�ѧ����ʽ ��
��6��д��һ�ַ�������������C��ͬ���칹��Ľṹ��ʽ____ ___��
�� ���ڷ����廯����� �ܷ���������Ӧ���� ��FeCl3��Һ�ܷ�����ɫ��Ӧ���� �˴Ź���������4��壬�ҷ����֮��Ϊl:l:2:2
���𰸡���1���ǻ����Ȼ���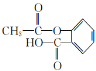 ��
��
��2��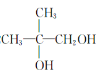 ����ȥ��Ӧ
����ȥ��Ӧ
��3�� 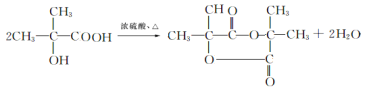 ��
��
��4��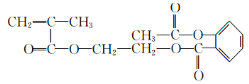 ��
��
��5��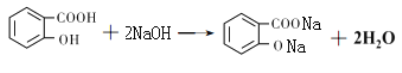
��6��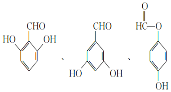
��������
���������������Ϣ���֪����ϩ�ڸ�����ء����������±���������BΪHOCH2CH2OH������Ϣ���֪��![]() ����������Ӧ����DΪ
����������Ӧ����DΪ![]() ��F��������������G��G������������ͭ��Ӧ����H���� FΪ����G����ȩ����H�����Ȼ���G��-CHO����Ϊ�Ȼ���L����Ԫ��������H��L�ķ���ʽ��֪��Ӧ��2����H��ȥ2����ˮ����������Ӧ����H�л�����-OH����-OH��-COOH������ͬһ̼ԭ���ϣ���̼ԭ�Ӳ���Hԭ�ӣ���HΪ
��F��������������G��G������������ͭ��Ӧ����H���� FΪ����G����ȩ����H�����Ȼ���G��-CHO����Ϊ�Ȼ���L����Ԫ��������H��L�ķ���ʽ��֪��Ӧ��2����H��ȥ2����ˮ����������Ӧ����H�л�����-OH����-OH��-COOH������ͬһ̼ԭ���ϣ���̼ԭ�Ӳ���Hԭ�ӣ���HΪ![]() �����ƿɵ�GΪ
�����ƿɵ�GΪ![]() ��FΪ
��FΪ![]() ����EΪ��CH3��2C=CH2��B��D��J��Ӧ����K��K��M���ڼӾ۷�Ӧ��M����ʽ�ǣ�Cl5Hl6O6��n����M��������ɿ�֪��Ӧ��1����B��1����D��1����J��Ӧ����K����H��Ũ���ᡢ���������·�����ȥ��Ӧ����JΪCH2=C��CH3��COOH��KΪ
����EΪ��CH3��2C=CH2��B��D��J��Ӧ����K��K��M���ڼӾ۷�Ӧ��M����ʽ�ǣ�Cl5Hl6O6��n����M��������ɿ�֪��Ӧ��1����B��1����D��1����J��Ӧ����K����H��Ũ���ᡢ���������·�����ȥ��Ӧ����JΪCH2=C��CH3��COOH��KΪ![]() ��MΪ
��MΪ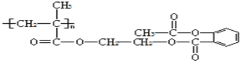 ���ݴ�����
���ݴ�����
��1��CΪ![]() �����к��������ŵ������ǻ����Ȼ���D�Ľṹ��ʽΪ
�����к��������ŵ������ǻ����Ȼ���D�Ľṹ��ʽΪ![]() ��
��
��2��F�Ľṹ��ʽΪ![]() ��H��J�ķ�Ӧ����Ϊ��ȥ��Ӧ��
��H��J�ķ�Ӧ����Ϊ��ȥ��Ӧ��
��3��H��L�Ļ�ѧ��Ӧ����ʽ�� ��
��
��4��K�Ľṹ��ʽ��![]() ��
��
��5��C������NaOH��Һ��Ӧ�Ļ�ѧ����ʽΪ ��
��
��6��CΪ![]() ����ͬ���칹������������ ���ڷ����廯����� �ܷ���������Ӧ������ȩ������ ��FeCl3��Һ�ܷ�����ɫ��Ӧ�����з��ǻ����� �˴Ź���������4��壬�ҷ����֮��Ϊl:l:2:2���ṹ��ʽΪ
����ͬ���칹������������ ���ڷ����廯����� �ܷ���������Ӧ������ȩ������ ��FeCl3��Һ�ܷ�����ɫ��Ӧ�����з��ǻ����� �˴Ź���������4��壬�ҷ����֮��Ϊl:l:2:2���ṹ��ʽΪ ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������H����Fe2����Cu2����Ag���������ӵ���Һ�м�������þ�ۣ����ȵõ��Ļ�ԭ������( )
A��H2 B��Fe C��Cu D��Ag
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����SO![]() ��Fe2����Br����I����0.1 mol����Һ��ͨ���״���µ�Cl2��ͨ��Cl2���������Һ��������ӵ����ʵ�������ϵͼ��ȷ���� ( )
��Fe2����Br����I����0.1 mol����Һ��ͨ���״���µ�Cl2��ͨ��Cl2���������Һ��������ӵ����ʵ�������ϵͼ��ȷ���� ( )
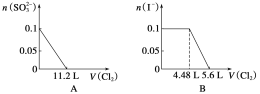

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ����ˮ�ʼ��վ����480 mL 0.5 mol��L��1NaOH��Һ�Ա�ʹ�á�
��1����ͬѧӦѡ��________mL������ƿ��ʹ������ƿǰ������е�һ��������______________
��2���������������ͼ��ʾ������ͼ����Ӧ����ͼ�е�____________����ѡ����ĸ��֮�䡣
A�������� B�������� C��������
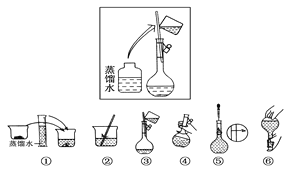
��3����ͬѧӦ��ȡNaOH����________g
��4�����в�����������Һ��Ũ�ȴ�С�к�Ӱ�죿����ƫ������ƫ����������Ӱ������գ�
������ʱ���ӿ̶��ߣ� ��
��ҡ�Ⱥ�Һ����ڿ̶��ߣ�û���ټ�ˮ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڷ�Ӧ3NO2��H2O===2HNO3��NO�У�������ԭ��Ӧ�ͷ���������Ӧ����������֮��Ϊ( )
A��3��1 B��1��3 C��1��2 D��2��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��д��ȷ����
A. �������ڴ�����Һ��NH3+H+��NH4+
B. ����������ͨ����������������Һ�У�H2S+2OH-��S2-+2H2O
C. ���Ȼ�������Һ�м�����ˮ��Fe2++Br2��Fe3++2Br-
D. ̼��������Һ�м���������ʯ��ˮ��2HCO3-+Ca2++2OH-��CaCO3��+CO32-+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʯ����Ҫ�ɷ�BaCO3����Ca2+��Mg2+��Fe3+�����ʣ���ʵ�������ö���ʯ�Ʊ�BaCl22H2O���������£�
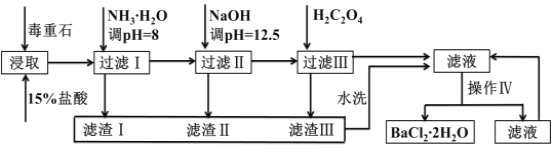
Ca2+ | Mg2+ | Fe3+ | |
��ʼ������pH | 11.9 | 9.1 | 1.9[ |
��ȫ������pH | 13.9 | 11.1 | 3.2 |
��֪��Ksp��BaC2O4��= 1.6��10�C7��Ksp��CaC2O4��= 2.3��10�C9
��1��ʵ������37%����������1mol/L���ᣬ���������У�����Ҫʹ�õ���_______ __
a������ƿ b����Ͳ c���ձ� d���ζ���
Ϊ�˼ӿ춾��ʯ��������ʣ����Բ�ȡ�Ĵ�ʩ��______________��������������
��2�����백ˮ������ҺpH=8��Ŀ����___________________________���������к�________���ѧʽ��������H2C2O4ʱӦ���������ԭ����___ __ ____________��
��3���������IJ����ǣ�______ ______�����ˡ�
��4�����ü�����ζ����ɲⶨBa2+�ĺ�����ʵ����������С�
��֪��2CrO42��+2H+=Cr2O72��+H2O ��Ba2++CrO42�� =BaCrO4��
�������ȡx mLһ��Ũ�ȵ�Na2CrO4��Һ����ƿ�У��������ָʾ������b mol��L��1�����Һ�ζ����յ�����õμ��������ΪV0 mL��
�������ȡy mL BaCl2��Һ����ƿ�У�����x mL�벽�����ͬŨ�ȵ�Na2CrO4��Һ����Ba2+��ȫ�������ټ������ָʾ������b mol��L��1�����Һ�ζ����յ㣬��õμ���������ΪV1 mL��
ͨ�����㣬�Ȼ�����ҺŨ��Ϊ___________mol��L��1(�ú���ĸ��ʽ�ӱ�ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijԭ��ط�Ӧ�����ӷ���ʽΪ��Zn��2H��=Zn2����H2����������˵����ȷ����
A. HNO3�����������Һ B. ���Ӵ������ص�������
C. п���������� D. ʯī����ԭ��ص�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�У�A��B��C��D��E�ǵ��ʣ�G��H��I��F��B��C��D��E�ֱ��A�γɵĶ�Ԫ�����
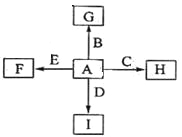
��֪��
�ٷ�Ӧ![]() �ܷų��������ȣ��÷�Ӧ��Ӧ��������ĺ��ӣ�
�ܷų��������ȣ��÷�Ӧ��Ӧ��������ĺ��ӣ�
��I��һ�ֳ������������壬����E���Է�����Ӧ��![]() ��F��EԪ�ص���������Ϊ60%��
��F��EԪ�ص���������Ϊ60%��
�ش����⣺
��1�����з�Ӧ�Ļ�ѧ����ʽΪ ��
��2��������I�ĵ���ʽΪ ��
��3��C�����NaOH��Һ��Ӧ�����ӷ���ʽΪ ����Ӧ�����������������I��Ӧ�����ӷ���ʽΪ ��
��4��E��I��ȼ�չ۲쵽�������� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com