
【题目】原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关.已知常温下,有下列3个装置.下列说法中正确的是( )

A.①②中Mg作负极,③中Fe作负极
B.②中Al作正极,其电极反应式为Al﹣3e﹣=Al3+
C.③中Fe作负极,电极反应式为Fe﹣2e﹣=Fe2+
D.若①②中转移的电子数相同,则①②中产生的H2的量也一定相同
【答案】D
【解析】
试题分析:A.①中更活泼的金属镁失电子作负极,②中镁不能与碱反应,铝与氢氧化钠发生氧化还原反应,则铝作负极,③中铁在浓硝酸中会钝化,铜作负极;
B.②中镁不能与碱反应,铝与氢氧化钠发生氧化还原反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,铝作负极失电子被氧化产生AlO2﹣;
C.③中铁在浓硝酸中会钝化,铜作负极发生氧化反应;
D.①②中产生的都是氢气,转移电子数相同,产生的氢气的量相同.
解:A.①中更活泼的金属镁失电子作负极,②中镁不能与碱反应,铝与氢氧化钠发生氧化还原反应,则铝作负极,③中铁在浓硝酸中会钝化,铜作负极,故A错误;
B.②中镁不能与碱反应,铝与氢氧化钠发生氧化还原反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,铝作负极失电子被氧化,电极反应为:2Al+8OH﹣﹣6e﹣=2AlO2﹣+4H2O,Mg作为正极,电极反应式为6H2O+6e﹣═6OH﹣+3H2↑,故B错误;
C.③中铁在浓硝酸中会钝化,铜作负极发生氧化反应,所以铜失电子生成铜离子,即电极反应式为Cu﹣2e﹣═Cu2+,故C错误;
D.①②中产生的都是氢气,H2~2e﹣,转移电子数相同,产生的氢气的量相同,故D正确;
故选D.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】分现有部分元素的性质与原子(或分子)结构如下表:
元素编号 | 元素性质与原子(或分子)结构 |
X | 地壳中含量最高的非金属元素 |
Y | M层比K层多1个电子 |
Z | 最外层电子数为内层电子数的0.6倍 |
W | 与氯形成的氯化物是生活中常用的调味品 |
(1)X形成的双原子分子的结构式为 ,X形成的氢化物的沸点在同族元素形成的氢化物中是 (填“最高”或“最低”),原因是 。
(2)金属冶炼Y单质的化学方程式为 。
(3)Y单质与W元素的最高价氧化物对应水化物恰好反应完全,向反应后的溶液中通入过量的CO2,发生反应的离子方程式为 。
(4)单质Cu在一定条件下与足量Z元素形成的强酸浓溶液反应生成的气体是 (填化学式),检验该气体的常用试剂 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为制取纯净干燥的Cl2并让其与铁发生反应的装置,A是Cl2发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置.试回答:
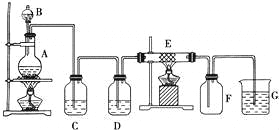
(1)C、G两个装置所盛放的试剂分别是: C G .
(2)①装置搭好须进行气密性检查,写出操作方法: .
②两处酒精灯应先点燃 处(填写A或B),目的是 .
③F中的现象为 ,G中出现了一种沉淀,该沉淀的化学式 .
(3)写出在A、E中发生反应的化学方程式为:
A: .
E: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计装置如图所示:

(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此 时,应向污水中加入适量的 。
a.H2SO4 b.BaSO4 c.Na2SO4 d.NaOH
(2)电解池阳极的电极反应分别是① ;②4OH--4e-=2H2O+O2↑。
(3)电极反应①和②的生成物反应得到Fe(OH)3沉淀的离子方程式是 。
(4)熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。
①已知负极的电极反应是CH4+4CO32-- 8e-=5CO2+2H2O。正极的电极反应是 。
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环。则A物质的化学式是 。
(5)实验过程中,若在阴极产生了44.8 L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况) L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定固定容积的密闭容器中,CO2(g)与一定量的C(s)发生进行如下化学反应:CO2(g)+C(s)2CO(g).
①该反应为 反应(填“吸热”或“放热”).
②该反应的反应速率随时间的变化图象如图所示,则下列说法正确的是 (填序号).
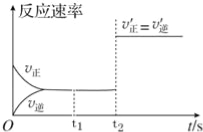
a.t1时刻该反应已经处于化学平衡状态
b.t2时刻c(CO2)=c(CO)
c.t2时刻该反应仍然处于化学平衡状态
d.t2时刻,改变的条件可能是增大了C的物质的量.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组为了模拟工业流程从浓缩的海水中提取液溴,查阅资料知:Br2的沸点为59℃,微溶于水,有毒性。设计了如下操作步骤及主要实验装置(夹持装置略去):

①连接A与B,关闭活塞b、d,打开活塞a、c,向A中缓慢通入至反应结束;
②关闭a、c,打开b、d,向A中鼓入足量热空气;
③进行步骤②的同时,向B中通入足量SO2 ;
④关闭b,打开a,再通过A向B中缓慢通入足量Cl2 ;
⑤将B中所得液体进行蒸馏,收集液溴。
请回答:
(1)实验室中采用固液加热制备氯气的化学方程式为______________________;
(2)步骤②中鼓入热空气的作用为_________________________;
(3)步骤③B中发生的主要反应的离子方程式为_____________________。
(4)此实验中尾气可用______________(填选项字母)吸收处理。
a.水 b.浓硫酸 c.NaOH溶液 d.饱和NaCl溶液
(5)步骤⑤中,用下图所示装置进行蒸馏,收集液溴,将装置图中缺少的必要仪器补画出来。

(6)若直接连接A与C,进行步骤①和②,充分反应后,向锥形瓶中滴加稀硫酸,再经步骤⑤,也能制得液溴。滴加稀硫酸之前,C中反应生成了NaBrO3等,该反应的化学方程式为_________________。
(7)与B装置相比,采用C装置的优点为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将质量为12.64g KMnO4固体加热一段时间后,收集到amolO2;向反应后残留的固体中加入足量的浓盐酸,又收集到bmolCl2,此时Mn元素全部以Mn2+的形式存在于溶液中。
(1)请完成并配平下列化学方程式:
K2MnO4+ HCl - KCl+ MnCl2+ Cl2↑+![]()
(2)用酸性高锰酸钾溶液滴定FeSO4溶液写出该反应的离子方程式______________。
(3)当KMnO4固体加热生成O2 a mol值最大时,向反应后残留的固体中加入足量的浓盐酸并加热,产生Cl2的物质的量b= mol。(此时Mn元素全部以Mn2+的形式存在于溶液中)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂方案错误的是( )
选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
A. | CO(g) | CO2(g) | NaOH溶液、浓H2SO4 | 洗气 |
B. | NH4Cl(aq) | Fe3+(aq) | NaOH溶液 | 过滤 |
C. | Cl2(g) | HCl(g) | 饱和食盐水、浓H2SO4 | 洗气 |
D. | Na2CO3(s) | NaHCO3(s) | — | 灼烧 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的两种物质相互作用时,在温度、反应物用量、反应物浓度等发生变化时,不会引起产物变化的是 ( )
A. 硫与氧气 B. 钠与氧气
C. 纯碱溶液与稀盐酸 D. 铁与HNO3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com