
【题目】一定温度下在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如下图。下列叙述中正确的是

A. 反应的化学方程式为5YX
B. t1时,Y的浓度是X浓度的1.5倍
C. t2时,正、逆反应速率相等
D. t3时,逆反应速率大于正反应速率
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有用饱和Na2SO4溶液浸泡过的琼脂。下列说法正确的是

A.b电极上发生的反应:Fe2+ - e- ═ Fe3+
B.a电极上发生氧化反应:MnO4- + 8H+ + 5e- ═ Mn2+ + 4H2O
C.外电路电子的流向是从a到b
D.电池工作时,盐桥中的SO42-移向甲烧杯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究FeSO4和Cu(NO3)2的混合物中各组分的含量,现设计如下流程:
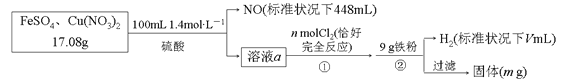
下列叙述中不正确的是
A.n=0.02 B.V=2240
C.m=3.2 D.原混合物中FeSO4的质量分数约为89%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)从古至今,铁及其化合物在人类生产生活中的作用发生了巨大改变。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是 (填字母序号)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料——红氧化铁的工艺流程如下(部分操作和条件略):

回答下列问题:
①在步骤i中产生的有毒气体可能有_____________。
②在步骤iii操作中,要除去的离子之一为Al3+。若常温时Ksp[Al(OH)3]=1.0×1032,此时理论上将Al3+沉淀完全,则溶液的pH为______。
③步骤iv中,生成FeCO3的离子方程式是_______________________________。
(3)氯化铁溶液称为化学试剂中的“多面手”。向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生沉淀,写出该沉淀的化学式 。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释 。
(4)①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:
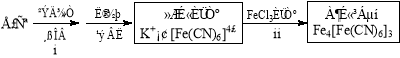
复分解反应ii的离子方程式是 。
②如今基于普鲁士蓝合成原理可检测食品中是否含CN,方案如下:
![]()
若试纸变蓝则证明食品中含有CN,请解释检测时试纸中FeSO4的作用 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化尿素是一种新型漂泊、消毒剂,广泛应用与农业、医药、日用化工等领域。用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素。反应的方程式为:
CO(NH2)2+H2O2![]() CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
CO(NH2)2·H2O2 | 白色晶体 | 45℃ | 75~85℃ | 易溶于水、有机溶剂 |
合成过氧化尿素的流程及反应装置图如图:

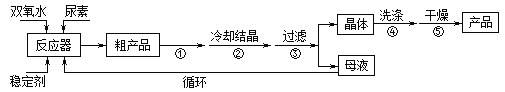
请回答下列问题:
(1)仪器X的名称是__________;冷凝管中冷却水从____(填“a”或“b”)口出来;
(2)该反应的温度控制30℃而不能过高的原因是_______________________。
(3)步骤①宜采用的操作是_____________。
A.加热蒸发 B.常压蒸发 C.减压蒸发
(4)若实验室制得少量该晶体,过滤后需要用冷水洗涤,具体的洗涤操作是_________________。
(5)准确称取1.000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加2mL6mol·L﹣1H2SO4,用0.2000mol·L﹣1KMnO4标准溶液滴定至终点时消耗18.00mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2·H2O2的质量分数为_____________;若滴定后俯视读数,则测得的过氧化尿素含量________(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属钠的性质和用途的描述中体现了它的强还原性的是
A. 钠可以用刀切割 B. 钠可以保存在煤油中
C. 钠可以用于冶炼金属钛 D. 钾钠合金用于核反应堆的导热剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别向等体积1mol/L盐酸和1mol/L醋酸溶液中加入等量的镁条,反应时间与溶液pH变化关系如右图。下列说法中不正确的是( )

A. Y代表盐酸与镁条的反应
B. a点时反应Y消耗镁条的量少
C. b点表示此时两溶液pH相等
D. c点表示此时反应结束
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下将3 mol CO2和2 mol H2混合于2 L的密闭容器中,发生如下反应:
CO2(g)+H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
(1)已知在700 ℃时,该反应的平衡常数K1=0.6,则该温度下反应![]() CO2(g)+
CO2(g)+![]() H2(g)
H2(g)![]()
![]() CO(g)+
CO(g)+![]() H2O(g)的平衡常数K3=__________。
H2O(g)的平衡常数K3=__________。
(2)已知在1 000 ℃时,该反应的平衡常数K4为1.0,则该反应为__________反应(填“吸热”或“放热”)。
(3)能判断该反应达到化学平衡状态的依据是________。(填编号)
A.容器中压强不变 B.c(CO2)=c(CO)
C.生成a mol CO2的同时消耗a mol H2 D.混合气体的平均相对分子质量不变
(4)在1 000 ℃下,某时刻CO2的物质的量为2.0 mol,则此时v正______v逆(填“>”、“=”或“<”)。该温度下反应达到平衡时,CO2的转化率为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com